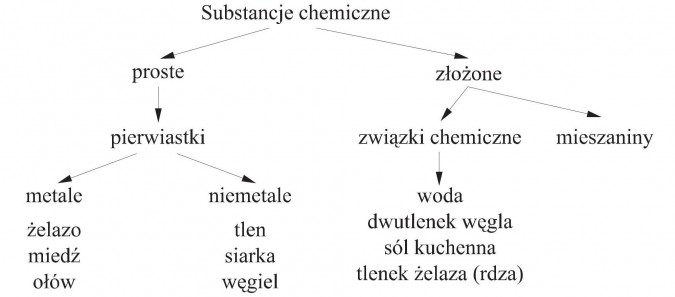
Otaczający nas świat zbudowany jest z materii. Materia ta występuje w różnych postaciach. Możemy ją podzielić na substancje chemiczne i mieszaniny.
Substancja chemiczna to materia o określonym składzie i właściwościach. Może to być pierwiastek, związek chemiczny albo czysta substancja prosta. Charakteryzuje się stałymi właściwościami fizycznymi i chemicznymi. Przykładem substancji chemicznej jest woda (H₂O) lub sól kuchenna (NaCl).
Pierwiastki i związki chemiczne
Pierwiastek to najprostsza forma materii, której nie można rozłożyć na prostsze substancje za pomocą metod chemicznych. Składa się z atomów o tej samej liczbie protonów w jądrze. Przykłady to tlen (O), wodór (H) i węgiel (C).
Związek chemiczny powstaje w wyniku połączenia dwóch lub więcej pierwiastków w określonym stosunku. Połączenie to następuje poprzez wiązania chemiczne. Właściwości związku chemicznego różnią się od właściwości pierwiastków, z których został utworzony. Woda (H₂O) jest przykładem związku chemicznego, składającego się z wodoru i tlenu.
Mieszaniny
Mieszaniny powstają przez fizyczne zmieszanie dwóch lub więcej substancji. Substancje w mieszaninie zachowują swoje właściwości. Mieszaniny można rozdzielić na poszczególne składniki metodami fizycznymi. Przykładem mieszaniny jest powietrze, które składa się głównie z azotu i tlenu.
Przemiany chemiczne i fizyczne
Substancje chemiczne podlegają różnym przemianom. Dzielimy je na przemiany fizyczne i przemiany chemiczne.
Przemiany fizyczne
Przemiana fizyczna to zmiana stanu skupienia, kształtu lub objętości substancji. Nie powoduje zmiany w składzie chemicznym substancji. Przykłady to topnienie lodu (H₂O(s) → H₂O(l)), wrzenie wody (H₂O(l) → H₂O(g)) lub rozpuszczanie cukru w wodzie.
W przemianach fizycznych nie powstają nowe substancje. Zmieniają się tylko właściwości fizyczne substancji. Możemy rozróżnić kilka rodzajów przemian fizycznych: parowanie, skraplanie, topnienie, krzepnięcie, sublimacja i resublimacja. Są to zmiany stanów skupienia.
Przemiany chemiczne (reakcje chemiczne)
Przemiana chemiczna, zwana również reakcją chemiczną, to proces, w którym substancje (reagenty) przekształcają się w inne substancje (produkty). W trakcie reakcji chemicznej dochodzi do zerwania i/lub utworzenia nowych wiązań chemicznych. To powoduje zmiany w składzie chemicznym substancji.
Przykłady przemian chemicznych to spalanie drewna, rdzewienie żelaza (reakcja z tlenem), fotosynteza u roślin. W spalaniu drewna węgiel i inne związki zawarte w drewnie reagują z tlenem z powietrza, tworząc dwutlenek węgla, wodę i inne produkty.
Równania reakcji chemicznych
Reakcje chemiczne zapisuje się za pomocą równań reakcji chemicznych. Równanie chemiczne przedstawia reagenty i produkty reakcji, a także ich współczynniki stechiometryczne. Współczynniki stechiometryczne informują o stosunku molowym reagentów i produktów.
Na przykład, równanie reakcji spalania metanu (CH₄) w tlenie (O₂) wygląda następująco: CH₄ + 2O₂ → CO₂ + 2H₂O. Oznacza to, że jedna cząsteczka metanu reaguje z dwiema cząsteczkami tlenu, tworząc jedną cząsteczkę dwutlenku węgla i dwie cząsteczki wody. Równanie reakcji musi być zbilansowane, co oznacza, że liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania.
Czynniki wpływające na szybkość reakcji chemicznych
Szybkość reakcji chemicznej to szybkość, z jaką reagenty przekształcają się w produkty. Na szybkość reakcji chemicznej wpływa wiele czynników, w tym:
- Temperatura: Zazwyczaj wzrost temperatury przyspiesza reakcję.
- Stężenie reagentów: Zwiększenie stężenia reagentów zazwyczaj przyspiesza reakcję.
- Katalizatory: Katalizatory to substancje, które przyspieszają reakcję chemiczną, nie zużywając się w niej.
- Stopień rozdrobnienia reagentów: Zwiększenie stopnia rozdrobnienia reagentów, zwłaszcza w przypadku reakcji heterogenicznych (gdzie reagenty znajdują się w różnych fazach), przyspiesza reakcję.
Zrozumienie substancji chemicznych i ich przemian jest kluczowe w wielu dziedzinach nauki i technologii. Pozwala nam projektować nowe materiały, opracowywać nowe metody syntezy chemicznej oraz zrozumieć procesy zachodzące w otaczającym nas świecie.