Hej ósmoklasisto! Gotowy na sprawdzian z kwasów? Bez obaw, pomogę Ci się przygotować!
Czym są kwasy?
Kwasy to związki chemiczne, które mają specyficzne właściwości. Ważne, żeby je znać!
Charakteryzują się kwaśnym smakiem (ale nigdy ich nie próbuj!).
Mają pH mniejsze niż 7.
Powodują zmiany barwy wskaźników.
Budowa kwasów
Kwasy składają się z kationów wodoru (H+) i anionów reszty kwasowej.
Wzór ogólny kwasu to HnR, gdzie R to reszta kwasowa, a n to wartościowość reszty kwasowej.
Nazewnictwo kwasów
Rozróżniamy kwasy beztlenowe i tlenowe.
Kwasy beztlenowe
Zawierają tylko wodór i niemetal.
Nazwa tworzona jest przez dodanie przedrostka "kwas" i przyrostka "-wodorowy" do nazwy niemetalu.
Przykłady: kwas chlorowodorowy (HCl), kwas siarkowodorowy (H2S).
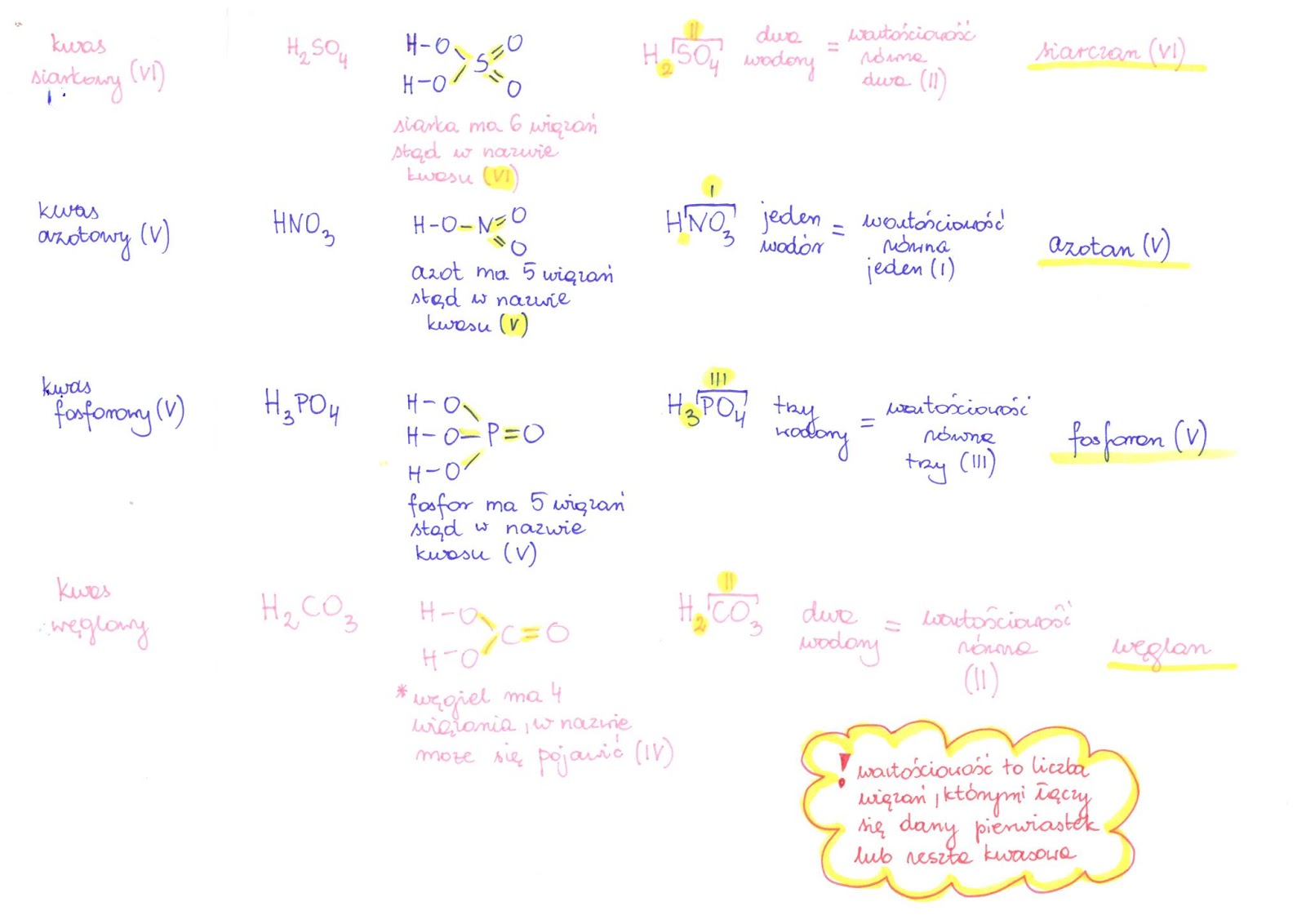
Kwasy tlenowe
Zawierają wodór, tlen i niemetal.
Nazwa zależy od wartościowości niemetalu.
Przykłady: kwas siarkowy(VI) (H2SO4), kwas azotowy(V) (HNO3), kwas węglowy (H2CO3).
Pamiętaj o rzymskich cyfrach w nawiasach – oznaczają one wartościowość niemetalu!
Właściwości kwasów
Kwasy reagują z różnymi substancjami. Zobaczmy z czym:
Reakcje z metalami
Nie wszystkie metale reagują z kwasami. Te które reagują, wypierają wodór z kwasu, tworząc sól.
Na przykład: Zn + 2HCl → ZnCl2 + H2.
Reakcje z tlenkami metali
Kwasy reagują z tlenkami metali, tworząc sól i wodę.
Na przykład: CuO + H2SO4 → CuSO4 + H2O.
Reakcje z zasadami (neutralizacja)
Reakcja kwasu z zasadą to reakcja neutralizacji.
Powstaje sól i woda.
Na przykład: HCl + NaOH → NaCl + H2O.
Działanie kwasów na wskaźniki
Kwasy zmieniają barwę wskaźników.
Lakmus w roztworze kwasu barwi się na czerwono.
Oranż metylowy w roztworze kwasu barwi się na czerwono.
Fenoloftaleina w roztworze kwasu pozostaje bezbarwna.
Dysocjacja kwasowa
Dysocjacja kwasowa to rozpad kwasu na jony w roztworze wodnym.
Kwasy dysocjują na kationy wodoru (H+) i aniony reszty kwasowej.
Na przykład: HCl → H+ + Cl-.
Kwasy w życiu codziennym
Kwasy mają wiele zastosowań w życiu codziennym i przemyśle.
Kwas solny (HCl) - stosowany w przemyśle, np. do czyszczenia metali.
Kwas siarkowy(VI) (H2SO4) - stosowany w produkcji nawozów, tworzyw sztucznych.
Kwas octowy (CH3COOH) - ocet spożywczy.
Kwas cytrynowy (C6H8O7) - dodawany do żywności jako konserwant.Kwasy mocne i słabe
Kwasy mocne dysocjują w roztworach wodnych całkowicie lub prawie całkowicie. Przykłady: HCl, H2SO4, HNO3.
Kwasy słabe dysocjują w roztworach wodnych tylko w niewielkim stopniu. Przykład: H2CO3, CH3COOH.
Reakcje charakterystyczne
Zapamiętaj kilka reakcji charakterystycznych!
- Reakcja kwasu z metalem: tworzenie soli i wodoru.
- Reakcja kwasu z tlenkiem metalu: tworzenie soli i wody.
- Reakcja kwasu z zasadą (neutralizacja): tworzenie soli i wody.
- Działanie kwasu na wskaźniki (lakmus, oranż metylowy, fenoloftaleina).
Bezpieczeństwo pracy z kwasami
Praca z kwasami wymaga ostrożności!
Zawsze używaj okularów ochronnych i rękawic.
Unikaj kontaktu kwasów ze skórą i oczami.
W przypadku kontaktu, natychmiast spłucz dużą ilością wody.
Pamiętaj! Kwasy rozcieńczamy zawsze wlewając kwas do wody, a nie odwrotnie! ("kwas na wodę")
Podsumowanie najważniejszych informacji
Kwasy: związki chemiczne zawierające wodór i resztę kwasową.
Nazewnictwo: kwasy beztlenowe (np. HCl) i tlenowe (np. H2SO4).
Właściwości: reagują z metalami, tlenkami metali i zasadami.
Wskaźniki: zmieniają barwę w roztworach kwasów (lakmus - czerwony, oranż metylowy - czerwony, fenoloftaleina - bezbarwna).
Dysocjacja kwasowa: rozpad kwasu na jony H+ i aniony reszty kwasowej.
Bezpieczeństwo: ostrożność podczas pracy z kwasami.
Powodzenia na sprawdzianie! Jesteś świetny i na pewno dasz radę!