Sól to związek chemiczny. Składa się z kationu metalu lub kationu amonu i anionu reszty kwasowej. Nazwa "sól" odnosi się do szerokiej grupy związków. Przykłady to chlorek sodu (sól kuchenna) i siarczan magnezu (sól gorzka).
Wzory i nazewnictwo soli
Wzór soli tworzy się na podstawie wzoru kwasu. Należy pamiętać o wartościowości. Wartościowość metalu i reszty kwasowej "krzyżuje się". Następnie stają się indeksami stechiometrycznymi. Na przykład, kwas siarkowy (VI) to H2SO4. Reszta kwasowa siarczanowa (VI) to SO42-. Jeżeli reaguje z wapniem (Ca2+), powstaje CaSO4, czyli siarczan (VI) wapnia.
Nazwy soli tworzy się od nazwy kwasu. Zmienia się końcówkę. Na przykład, sól kwasu solnego (chlorowodorowego) to chlorek. Sól kwasu siarkowego (VI) to siarczan (VI). Sól kwasu azotowego (V) to azotan (V). Należy podać nazwę kationu. Najczęściej jest to nazwa metalu, np. chlorek sodu, siarczan (VI) żelaza (II).
Przykłady wzorów i nazw soli
NaCl to chlorek sodu (sól kuchenna). Powstaje z kwasu chlorowodorowego (HCl) i wodorotlenku sodu (NaOH). CaCO3 to węglan wapnia (np. składnik kredy). Powstaje z kwasu węglowego (H2CO3) i wodorotlenku wapnia (Ca(OH)2). FeSO4 to siarczan (VI) żelaza (II). Powstaje z kwasu siarkowego (VI) (H2SO4) i wodorotlenku żelaza (II) (Fe(OH)2).
Otrzymywanie soli
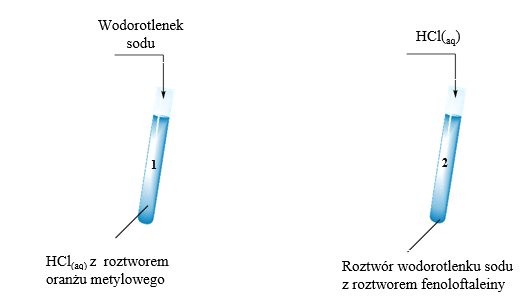
Sól można otrzymać na wiele sposobów. Najczęściej spotykane reakcje to reakcje kwasu z zasadą (reakcja zobojętniania). Kolejny sposób to reakcja metalu z kwasem. Można też otrzymać sól przez reakcję tlenku metalu z kwasem. Inną metodą jest reakcja metalu z niemetalem. Możliwa jest także reakcja wodorotlenku z tlenkiem kwasowym.
Reakcja zobojętniania polega na reakcji kwasu z zasadą. Produktami są sól i woda. Przykład: HCl + NaOH → NaCl + H2O (kwas chlorowodorowy + wodorotlenek sodu → chlorek sodu + woda). Reakcja metalu z kwasem: Mg + H2SO4 → MgSO4 + H2 (magnez + kwas siarkowy (VI) → siarczan (VI) magnezu + wodór).
Reakcja tlenku metalu z kwasem: CaO + 2HCl → CaCl2 + H2O (tlenek wapnia + kwas chlorowodorowy → chlorek wapnia + woda). Reakcja metalu z niemetalem: 2Na + Cl2 → 2NaCl (sód + chlor → chlorek sodu). Reakcja wodorotlenku z tlenkiem kwasowym: 2NaOH + SO2 → Na2SO3 + H2O (wodorotlenek sodu + tlenek siarki (IV) → siarczan (IV) sodu + woda).
Właściwości soli
Sól to zazwyczaj substancje stałe. Mają budowę krystaliczną. Często dobrze rozpuszczają się w wodzie. Roztwory soli przewodzą prąd elektryczny. Temperatura topnienia soli jest zazwyczaj wysoka. Niektóre sole wykazują właściwości higroskopijne (pochłaniają wilgoć z otoczenia).
Rozpuszczalność soli zależy od rodzaju soli i temperatury. Niektóre sole rozpuszczają się bardzo dobrze. Inne są praktycznie nierozpuszczalne. Większość soli rozpuszcza się lepiej w wyższej temperaturze. Wyjątki istnieją. Rozpuszczalność można sprawdzić w tabeli rozpuszczalności.
Zastosowanie soli
Sole mają szerokie zastosowanie. Chlorek sodu (NaCl) jest używany w kuchni jako przyprawa. Konserwuje też żywność. Węglan sodu (Na2CO3) jest używany w produkcji szkła i proszków do prania. Siarczan wapnia (CaSO4) (gips) stosuje się w budownictwie i medycynie.
Azotan (V) potasu (KNO3) jest używany jako nawóz. Jest także składnikiem prochu strzelniczego. Chlorek wapnia (CaCl2) jest używany do posypywania dróg zimą. Obniża temperaturę zamarzania wody. Wiele soli znajduje zastosowanie w przemyśle chemicznym. Są substratami do otrzymywania innych związków.
Hydroliza soli
Hydroliza to reakcja soli z wodą. Prowadzi do zmiany pH roztworu. Sole pochodzące od mocnych kwasów i mocnych zasad nie ulegają hydrolizie. Sole pochodzące od słabych kwasów i mocnych zasad hydrolizują. Roztwór ma odczyn zasadowy. Sole pochodzące od mocnych kwasów i słabych zasad hydrolizują. Roztwór ma odczyn kwasowy. Sole pochodzące od słabych kwasów i słabych zasad hydrolizują. Odczyn roztworu zależy od mocy kwasu i zasady.
Przykład: Chlorek amonu (NH4Cl) to sól mocnego kwasu (HCl) i słabej zasady (NH4OH). Ulega hydrolizie. Roztwór ma odczyn kwasowy. Węglan sodu (Na2CO3) to sól słabego kwasu (H2CO3) i mocnej zasady (NaOH). Ulega hydrolizie. Roztwór ma odczyn zasadowy.
Identyfikacja soli
Sole można identyfikować na podstawie charakterystycznych reakcji. Wykrywanie chlorków polega na dodaniu roztworu azotanu srebra (AgNO3). Powstaje biały, serowaty osad chlorku srebra (AgCl). Wykrywanie siarczanów polega na dodaniu roztworu chlorku baru (BaCl2). Powstaje biały osad siarczanu baru (BaSO4).
Wykrywanie węglanów polega na dodaniu kwasu. Wydziela się bezbarwny i bezwonny gaz – dwutlenek węgla (CO2). Można go zidentyfikować przepuszczając go przez wodę wapienną. Woda wapienna mętnieje. Identyfikację kationów metali przeprowadza się za pomocą analizy płomieniowej. Charakterystyczne zabarwienie płomienia pozwala na identyfikację metalu.