Hej! Zbliża się Sprawdzian z Chemii i pewnie czujesz lekką tremę. Spokojnie, jestem tu, żeby pomóc Ci wszystko usystematyzować i poczuć się pewniej. Przejdziemy przez najważniejsze zagadnienia krok po kroku, żebyś mógł/mogła błyszczeć na teście!
Budowa Atomu i Układ Okresowy Pierwiastków
Zacznijmy od podstaw, czyli od budowy atomu. Pamiętaj, że atom składa się z jądra, w którym znajdują się protony (ładunek dodatni) i neutrony (ładunek obojętny), oraz z elektronów (ładunek ujemny) krążących wokół jądra na orbitalach. Liczba protonów w jądrze to liczba atomowa (Z), która jednoznacznie identyfikuje pierwiastek. Natomiast suma protonów i neutronów to liczba masowa (A).
Izotopy
Ważne są też izotopy – atomy tego samego pierwiastka, które mają tę samą liczbę atomową (Z), ale różną liczbę masową (A). Różnią się one liczbą neutronów w jądrze. Przykładem są izotopy wodoru: prot (1H), deuter (2H) i tryt (3H).
Konfiguracja Elektronowa
Kolejny kluczowy temat to konfiguracja elektronowa. Ucz się pisać konfiguracje elektronowe dla różnych pierwiastków. Pamiętaj o zasadach: zakaz Pauliego (na jednym orbitalu mogą znajdować się maksymalnie dwa elektrony o przeciwnych spinach), regule Hunda (elektrony zajmują orbitalne pojedynczo, zanim zaczną się parować) oraz zasadzie minimalnej energii. Zwróć uwagę na wyjątki, takie jak chrom i miedź.
Układ Okresowy
Układ Okresowy Pierwiastków to Twój najlepszy przyjaciel! Zwróć uwagę na grupy (kolumny) i okresy (rzędy). Pierwiastki w tej samej grupie mają podobne właściwości chemiczne, ponieważ mają taką samą liczbę elektronów walencyjnych. Pamiętaj o podziale na metale, niemetale i półmetale. Umiejętność odczytywania informacji z układu okresowego (masa atomowa, liczba atomowa, symbol pierwiastka) jest absolutnie niezbędna.
Wiązania Chemiczne
Teraz przejdźmy do wiązań chemicznych. Rozróżniamy kilka podstawowych typów wiązań:
Wiązanie Jonowe
Wiązanie jonowe powstaje między atomami o dużej różnicy elektroujemności (zazwyczaj między metalem i niemetalem). Polega na przekazaniu elektronów od atomu metalu do atomu niemetalu, tworząc jony o przeciwnych ładunkach, które przyciągają się elektrostatycznie. Przykładem jest chlorek sodu (NaCl).
Wiązanie Kowalencyjne
Wiązanie kowalencyjne powstaje między atomami o zbliżonej elektroujemności (zazwyczaj między niemetalami). Polega na uwspólnianiu par elektronowych. Może być kowalencyjne niespolaryzowane (równy podział elektronów, np. w cząsteczce H2) lub kowalencyjne spolaryzowane (nierówny podział elektronów, np. w cząsteczce H2O).
Wiązanie Metaliczne
Wiązanie metaliczne występuje w metalach i polega na oddziaływaniu kationów metali z "morzem" elektronów walencyjnych.
Siły Międzycząsteczkowe
Oprócz wiązań chemicznych, istotne są także siły międzycząsteczkowe, takie jak siły Van der Waalsa (oddziaływania dipol-dipol, siły dyspersyjne Londona) i wiązania wodorowe. Wiązania wodorowe są szczególnie ważne w wodzie i mają wpływ na jej unikalne właściwości.
Stechiometria
Stechiometria to dział chemii zajmujący się ilościowymi zależnościami między reagentami i produktami w reakcjach chemicznych. Kluczem do sukcesu jest umiejętność bilansowania równań reakcji. Upewnij się, że liczba atomów każdego pierwiastka jest taka sama po obu stronach równania.
Obliczenia Molowe
Naucz się obliczać masę molową związków chemicznych (suma mas atomowych pierwiastków wchodzących w skład związku) i korzystać z liczby Avogadro (6.022 x 1023 cząsteczek/mol). Będziesz tego potrzebował/a do obliczeń stechiometrycznych.
Prawo Zachowania Mas
Pamiętaj o prawie zachowania masy – masa substratów jest równa masie produktów w reakcji chemicznej.
Reakcje w Roztworach
Ważne są również obliczenia związane z roztworami. Naucz się obliczać stężenie molowe (mol/dm3) i korzystać z rozcieńczeń roztworów (wzór: C1V1 = C2V2).
Reakcje Chemiczne
Znać rodzaje reakcji chemicznych jest konieczne. Rozróżniamy reakcje:
- Syntezy (łączenia)
- Analizy (rozkładu)
- Wymiany (pojedynczej i podwójnej)
Zwróć uwagę na reakcje redoks (utleniania-redukcji), gdzie następuje zmiana stopni utlenienia atomów. Naucz się przypisywać stopnie utlenienia i bilansować równania redoks.
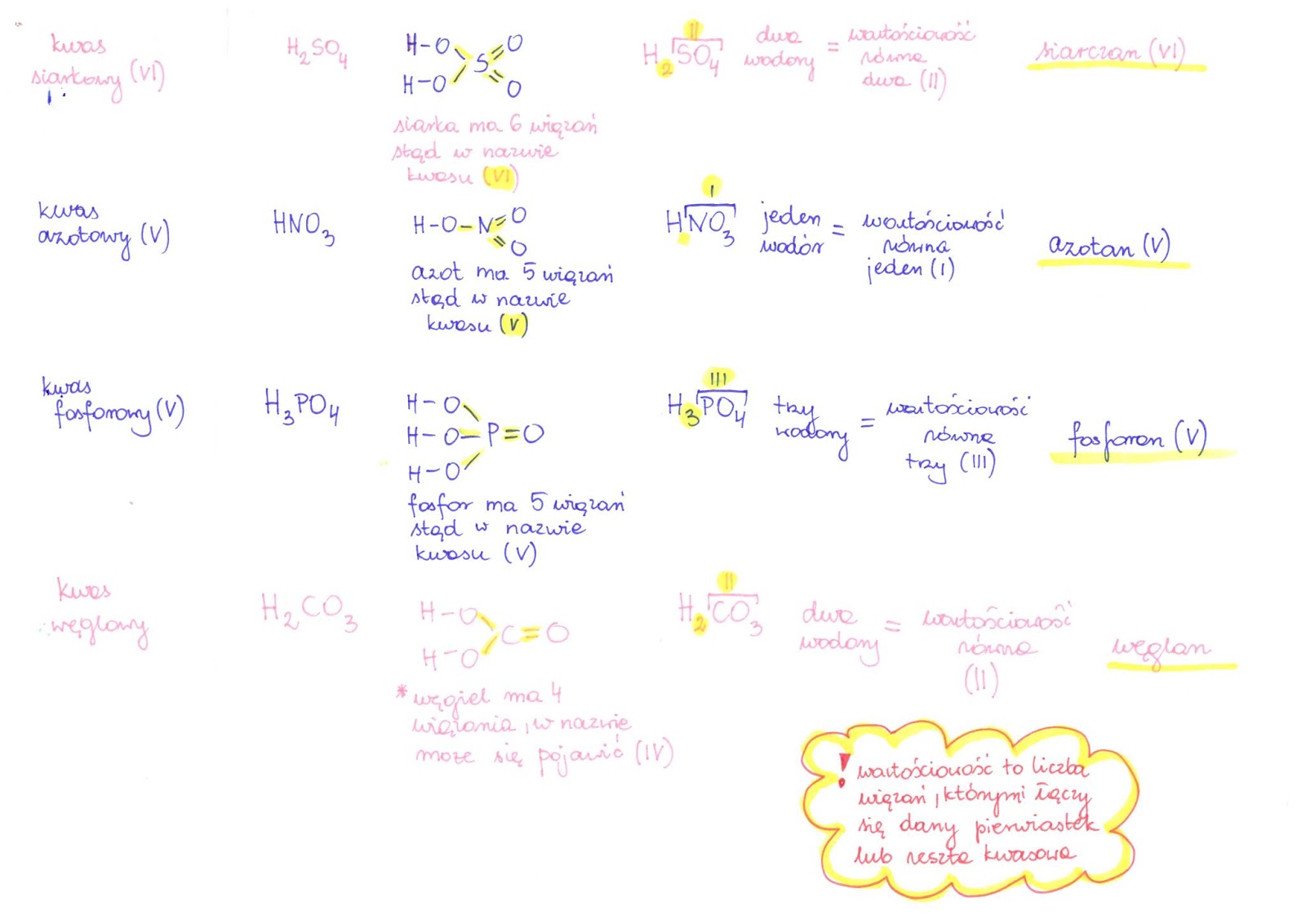
Kwasy i Zasady
Ostatni, ale nie mniej ważny temat to kwasy i zasady. Zdefiniuj kwasy i zasady zgodnie z teorią Arrheniusa (kwasy dysocjują na jony wodorowe H+, a zasady na jony wodorotlenkowe OH-) oraz Brønsteda-Lowry'ego (kwasy to donory protonów, a zasady to akceptory protonów).
Skala pH
Zrozumienie skali pH jest kluczowe. pH < 7 oznacza roztwór kwasowy, pH > 7 oznacza roztwór zasadowy, a pH = 7 oznacza roztwór obojętny. Pamiętaj, że pH = -log[H+].
Dysocjacja
Zrozum proces dysocjacji elektrolitycznej i wpływ stałej dysocjacji (Ka dla kwasów i Kb dla zasad) na moc kwasów i zasad.
Podsumowanie
To był intensywny przegląd najważniejszych zagadnień. Kluczowe punkty do zapamiętania:
- Budowa atomu: protony, neutrony, elektrony, liczba atomowa, liczba masowa, izotopy, konfiguracja elektronowa.
- Układ Okresowy: grupy, okresy, metale, niemetale, półmetale.
- Wiązania chemiczne: jonowe, kowalencyjne (spolaryzowane i niespolaryzowane), metaliczne, siły międzycząsteczkowe.
- Stechiometria: bilansowanie równań reakcji, masa molowa, liczba Avogadro, prawo zachowania masy, stężenie molowe.
- Reakcje chemiczne: syntezy, analizy, wymiany, reakcje redoks.
- Kwasy i zasady: definicje Arrheniusa i Brønsteda-Lowry'ego, skala pH, dysocjacja elektrolityczna.
Powodzenia na sprawdzianie! Pamiętaj, że regularna nauka i rozwiązywanie zadań to najlepszy sposób na przygotowanie. Wierzę w Ciebie!