Hej! Zaraz zanurzymy się w fascynujący świat węglowodorów! To bardzo ważny temat w chemii, szczególnie jeśli zbliża się sprawdzian z chemii w 8 klasie. Nie martw się, rozłożymy wszystko na czynniki pierwsze. Zobaczymy, że chemia wcale nie musi być straszna!
Czym są węglowodory?
Najprościej mówiąc, węglowodory to związki chemiczne, które składają się tylko z dwóch pierwiastków: węgla (C) i wodoru (H). To połączenie daje nam nieskończoną liczbę możliwości tworzenia różnych związków. Wyobraź sobie klocki LEGO - węgiel i wodór to nasze klocki, a różne kombinacje dają nam różne budowle – węglowodory.
Węgiel ma zdolność tworzenia bardzo trwałych wiązań z innymi atomami węgla. Może tworzyć długie łańcuchy, pierścienie, a nawet struktury trójwymiarowe. Wodór z kolei przyłącza się do wolnych miejsc na atomach węgla, stabilizując całą strukturę. To dlatego węglowodory są tak różnorodne.
Podział węglowodorów
Węglowodory dzielimy na kilka głównych grup, w zależności od rodzaju wiązań między atomami węgla. Zajmiemy się trzema najważniejszymi:
Węglowodory nasycone (alkany)
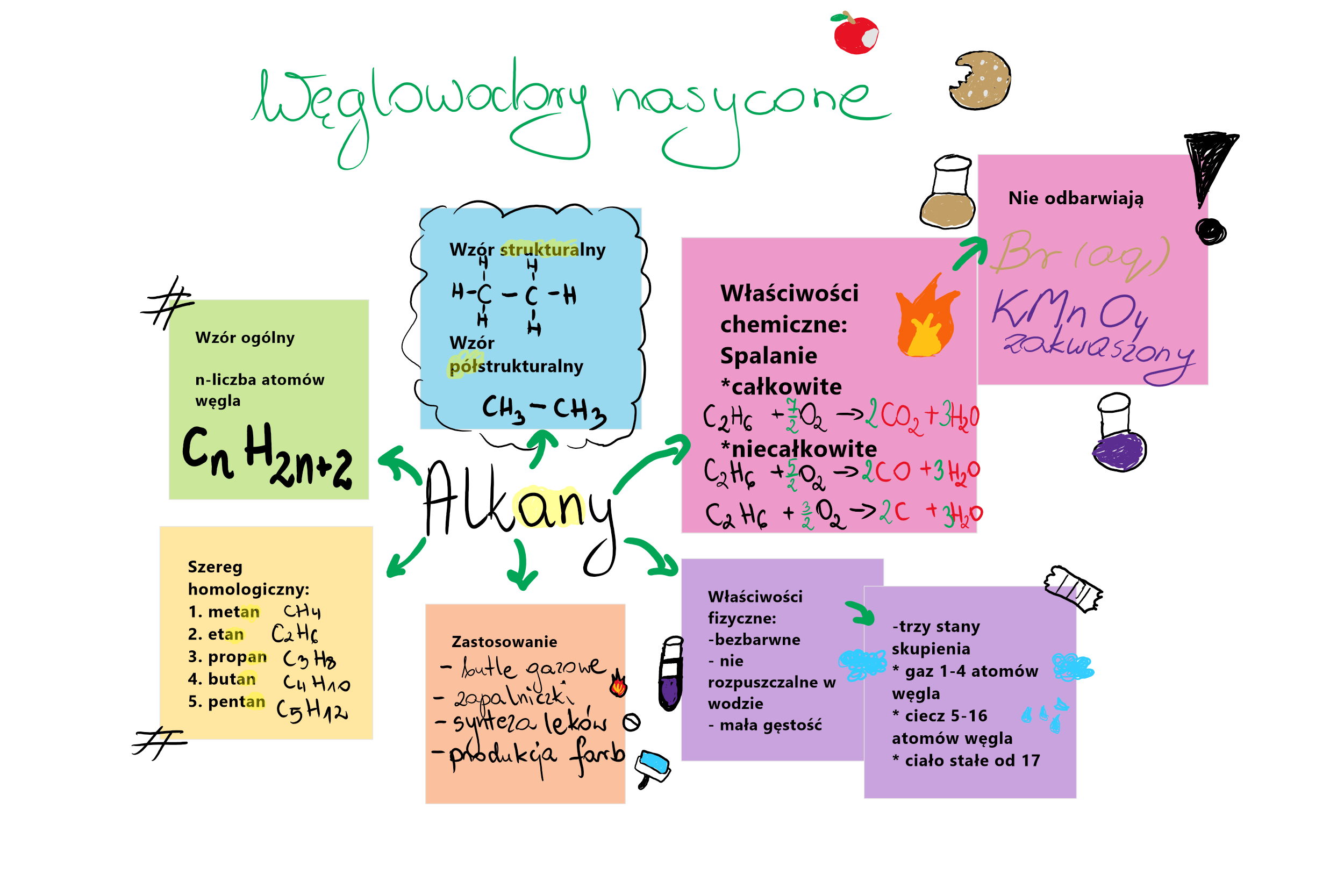
Alkany to węglowodory, w których między atomami węgla występują tylko wiązania pojedyncze. Są to związki "nasycone" wodorem, to znaczy każdy atom węgla jest połączony z maksymalną możliwą liczbą atomów wodoru. Mają ogólny wzór CnH2n+2, gdzie "n" oznacza liczbę atomów węgla w cząsteczce.
Przykłady alkanów z życia codziennego: metan (CH4) – główny składnik gazu ziemnego, używany do ogrzewania domów i gotowania. Etan (C2H6) – również składnik gazu ziemnego. Propan (C3H8) i butan (C4H10) – używane w butlach gazowych do kuchenek turystycznych i zapalniczek.
Węglowodory nienasycone – alkeny
Alkeny to węglowodory, w których występuje przynajmniej jedno wiązanie podwójne między atomami węgla. Mają ogólny wzór CnH2n. Obecność wiązania podwójnego sprawia, że są bardziej reaktywne niż alkany.
Najprostszy alken to eten (etylen) (C2H4). Jest używany do produkcji tworzyw sztucznych, takich jak polietylen (PE), z którego robi się folię, worki na śmieci i butelki.
Węglowodory nienasycone – alkiny
Alkiny to węglowodory, w których występuje przynajmniej jedno wiązanie potrójne między atomami węgla. Mają ogólny wzór CnH2n-2. Wiązanie potrójne sprawia, że są jeszcze bardziej reaktywne niż alkeny.
Najprostszy alkin to etyn (acetylen) (C2H2). Używa się go w palnikach acetylenowo-tlenowych do spawania i cięcia metali, ponieważ spalanie acetylenu daje bardzo wysoką temperaturę.
Reakcje węglowodorów
Węglowodory, jak wszystkie związki chemiczne, uczestniczą w różnych reakcjach. Dwie najważniejsze reakcje, które musisz znać to spalanie i reakcja addycji:
Spalanie
Spalanie to reakcja węglowodoru z tlenem (O2). Produktami spalania całkowitego są dwutlenek węgla (CO2) i woda (H2O). To właśnie spalanie węglowodorów, takich jak gaz ziemny czy benzyna, dostarcza nam energię do ogrzewania domów i napędzania samochodów.
Jeśli spalanie jest niecałkowite (czyli dostęp do tlenu jest ograniczony), powstaje również tlenek węgla (CO) – bardzo trujący gaz – oraz węgiel (C) w postaci sadzy. Dlatego ważne jest, aby urządzenia grzewcze były sprawne i dobrze wentylowane.
Reakcja addycji (przyłączania)
Reakcja addycji charakterystyczna jest dla węglowodorów nienasyconych (alkenów i alkinów). Polega na przyłączaniu atomów lub grup atomów do wiązania podwójnego lub potrójnego, co powoduje jego rozerwanie i powstanie wiązań pojedynczych. Na przykład, do etenu (C2H4) można przyłączyć atomy wodoru (H2), uzyskując etan (C2H6).
Nazewnictwo węglowodorów
Ważną częścią nauki o węglowodorach jest umiejętność ich nazywania. Nazwy węglowodorów tworzy się zgodnie z pewnymi zasadami. Przyjrzyjmy się temu na przykładzie alkanów:
1. Podstawą nazwy jest liczba atomów węgla w najdłuższym łańcuchu węglowym: * 1 atom węgla – met- * 2 atomy węgla – et- * 3 atomy węgla – prop- * 4 atomy węgla – but- * 5 atomów węgla – pent- * 6 atomów węgla – heks- * itd.
2. Do rdzenia dodajemy końcówkę, która informuje o rodzaju węglowodoru: * Alkany: -an (np. metan, etan, propan, butan) * Alkeny: -en (np. eten, propen, buten) * Alkiny: -in (np. etyn, propin, butin)
Dla bardziej skomplikowanych węglowodorów z rozgałęzieniami i podstawnikami stosuje się bardziej zaawansowane zasady nazewnictwa, ale na sprawdzian z chemii w 8 klasie wystarczy znajomość podstawowych zasad i nazw prostych węglowodorów.
Właściwości węglowodorów
Właściwości fizyczne węglowodorów (stan skupienia, temperatura wrzenia, rozpuszczalność) zależą od ich masy cząsteczkowej i struktury. Krótkie alkany (np. metan, etan) są gazami w temperaturze pokojowej, alkany o średniej długości łańcucha (np. pentan, heksan) są cieczami, a długie alkany są ciałami stałymi (np. parafina).
Węglowodory są słabo rozpuszczalne w wodzie, ale dobrze rozpuszczają się w rozpuszczalnikach organicznych, takich jak benzyna, eter czy alkohol. Wynika to z faktu, że węglowodory są związkami niepolarnymi, a woda jest związkiem polarnym ("podobne rozpuszcza się w podobnym").
Pamiętaj! Węglowodory to bardzo ważne związki, bez których nie moglibyśmy żyć tak, jak żyjemy. Są źródłem energii, materiałem do produkcji tworzyw sztucznych, leków i wielu innych produktów. Zrozumienie ich budowy i właściwości jest kluczowe w chemii i wielu innych dziedzinach nauki.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć węglowodory i przygotować się do sprawdzianu. Powodzenia!