Hej ósmoklasisto! Gotowy na sprawdzian z chemii o kwasach? Nie martw się, jestem tutaj, żeby Ci pomóc! Przejdziemy razem przez wszystko, co musisz wiedzieć. Dasz radę!
Co to są kwasy?
Kwasy to związki chemiczne, które mają specyficzne właściwości. Spróbujmy je zrozumieć.
Definicja kwasów
Najprościej mówiąc, kwasy to substancje, które w roztworze wodnym dysocjują na jony wodorowe (H+). To one odpowiadają za kwaśny smak i inne cechy kwasów.
Pamiętaj: jon wodorowy (H+) to klucz!
Właściwości kwasów
Kwasy mają kilka charakterystycznych cech:
- Kwaśny smak: Ale nigdy ich nie próbuj! W laboratorium to niebezpieczne.
- Reakcja z metalami: Niektóre kwasy reagują z metalami, tworząc wodór.
- Zmiana barwy wskaźników: Kwasy zmieniają barwę wskaźników.
- Reakcja z zasadami (neutralizacja): Kwasy reagują z zasadami, tworząc sól i wodę.
Zapamiętaj te cztery punkty. Będą na sprawdzianie!
Podział kwasów
Kwasy można podzielić na różne sposoby. Poznaj dwa najważniejsze podziały.
Kwasy beztlenowe
Kwasy beztlenowe to takie, które w swojej budowie nie zawierają atomów tlenu. Mają tylko wodór i niemetal.
Przykłady:
- Kwas chlorowodorowy (HCl) – inaczej kwas solny
- Kwas fluorowodorowy (HF)
- Kwas bromowodorowy (HBr)
- Kwas jodowodorowy (HI)
- Kwas siarkowodorowy (H2S)
Zauważ, że nazwa kwasu beztlenowego kończy się na "-wodorowy".
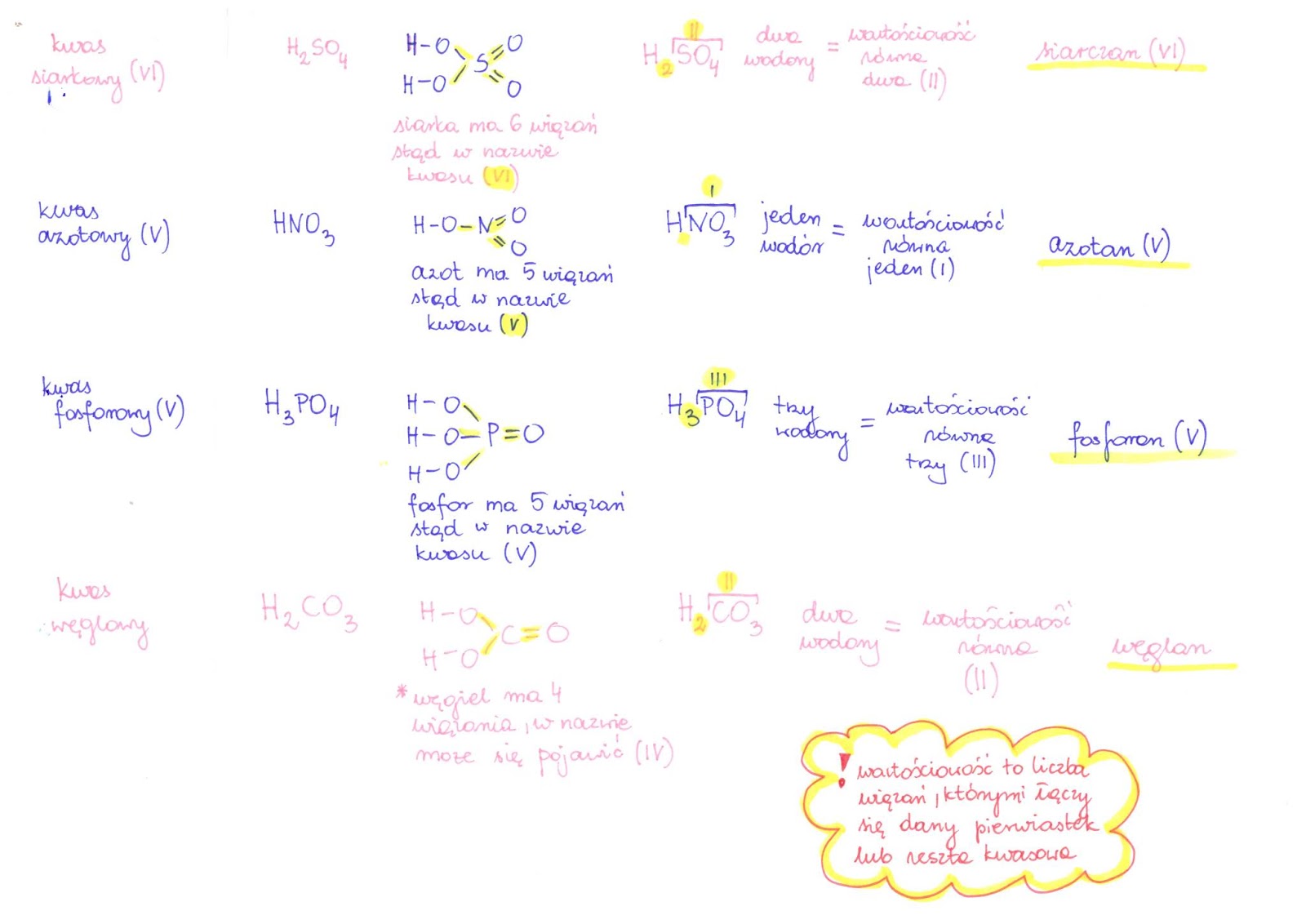
Kwasy tlenowe
Kwasy tlenowe zawierają w swojej budowie atomy tlenu. Składają się z wodoru, tlenu i niemetalu (lub metalu przejściowego w wysokim stopniu utlenienia).
Przykłady:
- Kwas siarkowy(VI) (H2SO4)
- Kwas azotowy(V) (HNO3)
- Kwas węglowy (H2CO3)
- Kwas fosforowy(V) (H3PO4)
Nazwa kwasu tlenowego zawiera informację o wartościowości niemetalu (rzymska cyfra w nawiasie). Często spotkasz nazwy zwyczajowe (np. kwas siarkowy zamiast kwas siarkowy(VI)).
Dysocjacja jonowa kwasów
Dysocjacja jonowa to rozpad związku na jony w roztworze wodnym. To bardzo ważne dla kwasów!
Kwasy pod wpływem wody rozpadają się na jony wodorowe (H+) i aniony reszty kwasowej.
Przykłady:
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
HNO3 → H+ + NO3-
Zauważ, że liczba jonów wodorowych zależy od kwasu. Kwas siarkowy(VI) dysocjuje na dwa jony wodorowe!
Wskaźniki
Wskaźniki, inaczej indykatory, to substancje, które zmieniają barwę w zależności od pH roztworu. Pomagają nam stwierdzić, czy roztwór jest kwaśny, zasadowy czy obojętny.
Najpopularniejsze wskaźniki:
- Lakmus: W kwasach czerwony.
- Oranż metylowy: W kwasach czerwony.
- Fenoloftaleina: W kwasach bezbarwna.
- Uniwersalny papierek wskaźnikowy: Przyjmuje różne barwy w zależności od pH (od czerwonego do żółtego w kwasach).
Zapamiętaj te barwy! To często pojawia się na sprawdzianach.
Reakcje kwasów
Kwasy wchodzą w różne reakcje chemiczne. Poznaj najważniejsze z nich.
Reakcja z metalami
Niektóre kwasy reagują z metalami, tworząc sól i wodór.
Przykład:
Zn + 2HCl → ZnCl2 + H2↑
Pamiętaj, że nie wszystkie metale reagują z kwasami. To zależy od aktywności metalu.
Reakcja z tlenkami metali
Kwasy reagują z tlenkami metali, tworząc sól i wodę.
Przykład:
CuO + 2HCl → CuCl2 + H2O
Reakcja zobojętniania (z zasadami)
To bardzo ważna reakcja! Kwasy reagują z zasadami (wodorotlenkami), tworząc sól i wodę. Mówimy o reakcji zobojętniania, bo kwasy i zasady neutralizują swoje właściwości.
Przykład:
HCl + NaOH → NaCl + H2O
Przykładowe zadania
Spróbuj rozwiązać te zadania. Pomogą Ci utrwalić wiedzę.
- Podaj wzór sumaryczny i nazwę kwasu beztlenowego, który zawiera chlor.
- Jak zmieni się barwa lakmusu w roztworze kwasu siarkowego(VI)?
- Napisz równanie reakcji kwasu chlorowodorowego z tlenkiem magnezu.
Podsumowanie
Gratulacje! Przeszliśmy przez najważniejsze zagadnienia dotyczące kwasów. Pamiętaj:
- Kwasy dysocjują na jony wodorowe (H+).
- Kwasy dzielimy na beztlenowe i tlenowe.
- Wskaźniki zmieniają barwę w obecności kwasów.
- Kwasy reagują z metalami, tlenkami metali i zasadami.
Powodzenia na sprawdzianie! Wierzę w Ciebie!