Sole to bardzo ważna grupa związków chemicznych. Spotykamy je na co dzień, choć często nie zdajemy sobie z tego sprawy. Sprawdzian z chemii w ósmej klasie często obejmuje właśnie sole, dlatego warto je dobrze poznać. Zajmijmy się nimi krok po kroku.
Czym są sole?
Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Ten proces nazywamy reakcją zobojętniania. Podczas tej reakcji, kwas oddaje kationy wodoru (H+), a zasada oddaje aniony wodorotlenkowe (OH-). Powstają woda (H2O) i właśnie sól.
Można też powiedzieć, że sole to związki chemiczne zbudowane z kationu metalu (lub kationu amonu NH4+) i anionu reszty kwasowej. Kation metalu to atom metalu, który oddał elektrony i stał się jonem dodatnim. Anion reszty kwasowej to grupa atomów pochodząca od kwasu, która przyjęła elektrony i stała się jonem ujemnym.
Przykłady soli
Chlorek sodu (NaCl), czyli sól kuchenna, to chyba najbardziej znana sól. Składa się z kationu sodu (Na+) i anionu chlorkowego (Cl-). Znajduje szerokie zastosowanie w kuchni, przemyśle spożywczym i chemicznym. Jest niezbędna do życia dla ludzi i zwierząt.
Siarczan miedzi(II) (CuSO4) to kolejna sól. Składa się z kationu miedzi(II) (Cu2+) i anionu siarczanowego(VI) (SO4 2-). Ma niebieski kolor i jest stosowany jako środek grzybobójczy w rolnictwie. Wykorzystuje się go także w laboratoriach chemicznych.
Azotan potasu (KNO3) to sól, która składa się z kationu potasu (K+) i anionu azotanowego(V) (NO3-). Jest stosowany jako nawóz w rolnictwie, ponieważ dostarcza roślinom potas i azot. Bywa też składnikiem prochu czarnego.
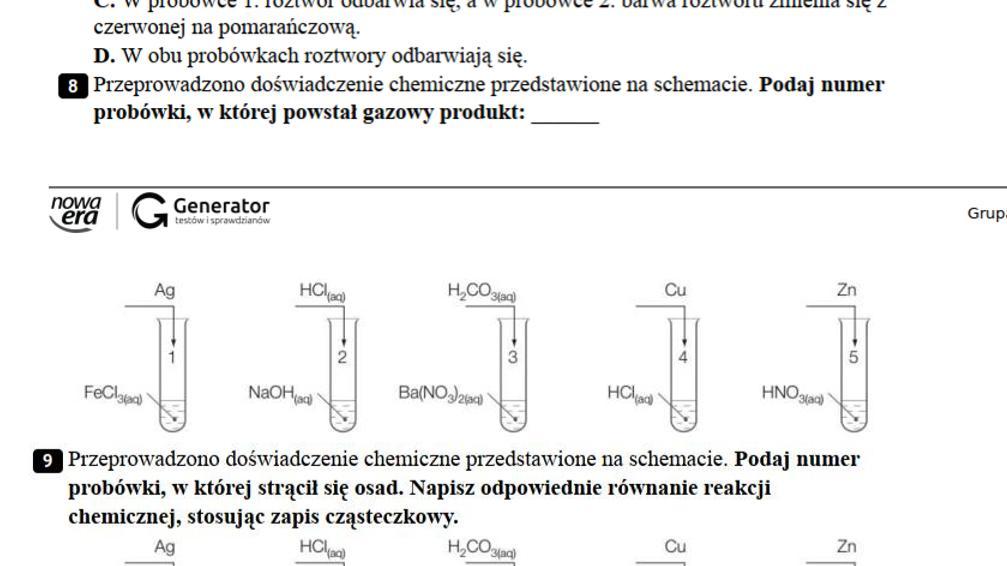
Nazewnictwo soli
Nazwy soli tworzymy, łącząc nazwę anionu reszty kwasowej z nazwą kationu metalu. Ważne jest, aby uwzględnić wartościowość metalu, jeśli ma on więcej niż jedną wartościowość. Robimy to, dodając w nawiasie po nazwie metalu cyfrę rzymską oznaczającą jego wartościowość.
Na przykład, chlorek żelaza(II) to sól zawierająca kation żelaza o wartościowości 2 (Fe2+) i anion chlorkowy (Cl-). Siarczan żelaza(III) to sól zawierająca kation żelaza o wartościowości 3 (Fe3+) i anion siarczanowy(VI) (SO4 2-). Brak wskazania wartościowości metalu sugeruje, że ma on tylko jedną możliwą.
Jeśli sól pochodzi od kwasu beztlenowego, to anion reszty kwasowej ma końcówkę "-ek". Na przykład, chlorek, siarczek, bromek. Jeśli sól pochodzi od kwasu tlenowego, to anion reszty kwasowej ma końcówkę "-an". Na przykład, siarczan, azotan, fosforan.
Właściwości soli
Sole to zazwyczaj substancje stałe o wysokich temperaturach topnienia i wrzenia. Wiele soli dobrze rozpuszcza się w wodzie, tworząc roztwory. Roztwory soli przewodzą prąd elektryczny, ponieważ zawierają jony.
Rozpuszczalność soli w wodzie jest różna. Niektóre sole rozpuszczają się bardzo dobrze, inne słabo, a jeszcze inne są praktycznie nierozpuszczalne. Rozpuszczalność soli zależy od temperatury - zazwyczaj im wyższa temperatura, tym lepiej sól się rozpuszcza.
Sole mogą mieć różne kolory. Przykładowo, chlorek kobaltu(II) jest różowy, siarczan miedzi(II) jest niebieski, a dichromian potasu jest pomarańczowy. Kolor soli zależy od rodzaju kationu metalu, który ją tworzy.
Otrzymywanie soli
Sole można otrzymać na wiele sposobów. Najprostszym sposobem jest reakcja kwasu z zasadą (reakcja zobojętniania). Inne sposoby to reakcja metalu z kwasem, reakcja tlenku metalu z kwasem, reakcja metalu z niemetalem i reakcja soli z kwasem lub zasadą.
Na przykład, chlorek sodu (NaCl) można otrzymać w reakcji kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH): HCl + NaOH -> NaCl + H2O. Siarczan miedzi(II) (CuSO4) można otrzymać w reakcji tlenku miedzi(II) (CuO) z kwasem siarkowym(VI) (H2SO4): CuO + H2SO4 -> CuSO4 + H2O.
Wybór metody otrzymywania soli zależy od tego, jaką sól chcemy otrzymać i jakie mamy dostępne substraty. Często stosuje się reakcje, które przebiegają szybko i wydajnie.
Zastosowania soli
Sole mają bardzo szerokie zastosowanie w różnych dziedzinach życia. Jak już wspomnieliśmy, chlorek sodu (NaCl) jest używany w kuchni i przemyśle spożywczym. Azotan potasu (KNO3) jest stosowany jako nawóz. Siarczan wapnia (CaSO4), czyli gips, jest używany w budownictwie.
W medycynie sole są stosowane jako leki, środki dezynfekujące i składniki płynów infuzyjnych. W przemyśle chemicznym sole są używane jako surowce do produkcji innych związków chemicznych. W rolnictwie sole są stosowane jako nawozy i środki ochrony roślin.
Sole są również ważne w procesach biologicznych. Na przykład, jony sodu (Na+) i potasu (K+) są niezbędne do przewodzenia impulsów nerwowych. Jony wapnia (Ca2+) są ważne dla krzepnięcia krwi i funkcjonowania mięśni. Sole mineralne są niezbędne do prawidłowego funkcjonowania organizmu.
Mamy nadzieję, że to wprowadzenie do tematu soli okaże się pomocne w przygotowaniu do sprawdzianu z chemii. Pamiętaj, że zrozumienie podstawowych definicji, przykładów i właściwości soli to klucz do sukcesu. Powodzenia!