Witaj! Porozmawiamy dziś o wodzie i roztworach wodnych, czyli o tematach często poruszanych na sprawdzianie z chemii w 7 klasie. Zrozumienie tych zagadnień jest kluczowe, więc postaram się wytłumaczyć wszystko krok po kroku.
Woda – Niezwykła Substancja
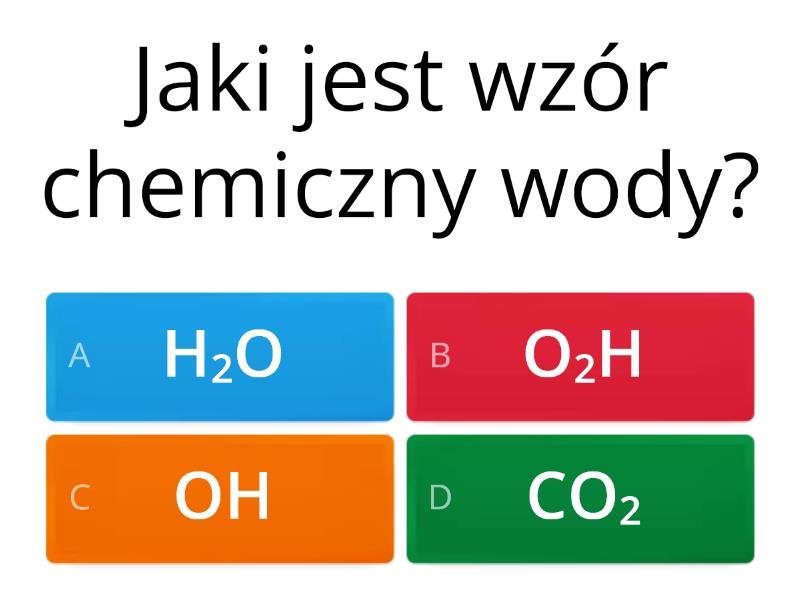
Zacznijmy od samej wody. Woda (H2O) to związek chemiczny składający się z dwóch atomów wodoru (H) i jednego atomu tlenu (O). To bardzo prosta budowa, ale właściwości wody są naprawdę wyjątkowe. Woda występuje w trzech stanach skupienia: stałym (lód), ciekłym (woda) i gazowym (para wodna). Zmiana stanu skupienia zależy od temperatury.
Dlaczego woda jest tak ważna? Przede wszystkim, jest niezbędna do życia. Wszystkie żywe organizmy, od najmniejszych bakterii po największe ssaki, potrzebują wody do prawidłowego funkcjonowania. Woda transportuje substancje odżywcze, reguluje temperaturę ciała i bierze udział w wielu reakcjach chemicznych zachodzących w organizmach. Woda to także bardzo dobry rozpuszczalnik, co oznacza, że wiele substancji może się w niej rozpuszczać.
Woda posiada specyficzną strukturę. Cząsteczka wody jest polarna, co oznacza, że ma dwa końce o różnym ładunku elektrycznym. Tlen przyciąga elektrony bardziej niż wodór, przez co na tlenie pojawia się niewielki ładunek ujemny (δ-), a na wodorach niewielki ładunek dodatni (δ+). Ta polarność powoduje, że cząsteczki wody przyciągają się wzajemnie, tworząc wiązania wodorowe. Wiązania wodorowe odpowiadają za wiele unikalnych właściwości wody, takich jak wysokie napięcie powierzchniowe i wysokie ciepło właściwe.
Roztwory Wodne – Mieszaniny Idealne
Skoro wiemy już co nieco o wodzie, możemy przejść do roztworów wodnych. Roztwór to jednorodna mieszanina dwóch lub więcej substancji. Oznacza to, że w roztworze nie widać gołym okiem, ani nawet pod mikroskopem, poszczególnych składników. W roztworze wodnym, woda jest rozpuszczalnikiem, czyli substancją, w której rozpuszcza się inna substancja, nazywana substancją rozpuszczoną.
Przykładem roztworu wodnego jest woda z solą kuchenną (NaCl). Kiedy wsypiesz sól do wody i zamieszasz, sól się rozpuści i otrzymasz roztwór soli. W tym przypadku woda jest rozpuszczalnikiem, a sól jest substancją rozpuszczoną. Inne przykłady to woda z cukrem, woda z sokiem, a nawet powietrze rozpuszczone w wodzie (dzięki czemu ryby mogą oddychać!).
Rozpuszczalność to zdolność danej substancji do rozpuszczania się w danej ilości rozpuszczalnika w określonej temperaturze. Rozpuszczalność zależy od wielu czynników, m.in. od rodzaju substancji rozpuszczanej, rodzaju rozpuszczalnika i temperatury. Zazwyczaj, rozpuszczalność ciał stałych wzrasta wraz ze wzrostem temperatury, a rozpuszczalność gazów maleje wraz ze wzrostem temperatury.
Rodzaje Roztworów
Roztwory dzielimy na różne rodzaje ze względu na ilość substancji rozpuszczonej: roztwory nienasycone, nasycone i przesycone. Roztwór nienasycony to taki roztwór, w którym w danej temperaturze można jeszcze rozpuścić dodatkową ilość substancji. Jeśli dodasz cukier do herbaty i cukier się rozpuści, a w herbacie nadal jest miejsce na więcej cukru, to masz roztwór nienasycony.
Roztwór nasycony to taki roztwór, w którym w danej temperaturze nie można już rozpuścić więcej substancji. Jeśli dodasz cukier do herbaty i cukier przestanie się rozpuszczać, a na dnie filiżanki zacznie osiadać, to masz roztwór nasycony. Ilość substancji rozpuszczonej w roztworze nasyconym nazywana jest rozpuszczalnością tej substancji w danej temperaturze. Z kolei roztwór przesycony to roztwór, który zawiera więcej substancji rozpuszczonej niż wynika to z rozpuszczalności w danej temperaturze. Roztwory przesycone są nietrwałe i łatwo wytrącają się z nich kryształy substancji rozpuszczonej.
Możemy także podzielić roztwory ze względu na stężenie substancji rozpuszczonej: roztwory rozcieńczone i stężone. Roztwór rozcieńczony zawiera małą ilość substancji rozpuszczonej w dużej ilości rozpuszczalnika. Natomiast roztwór stężony zawiera dużą ilość substancji rozpuszczonej w stosunkowo małej ilości rozpuszczalnika.
Stężenie Procentowe Roztworu
Stężenie procentowe roztworu (Cp) to wyrażony w procentach stosunek masy substancji rozpuszczonej (ms) do masy całego roztworu (mr). Obliczamy je ze wzoru: Cp = (ms / mr) * 100%. Przykładowo, jeśli rozpuścimy 10 g soli w 90 g wody, to masa roztworu wynosi 100 g, a stężenie procentowe roztworu wynosi (10 g / 100 g) * 100% = 10%. Oznacza to, że w 100 g roztworu znajduje się 10 g soli.
Aby obliczyć stężenie procentowe, musimy znać masę substancji rozpuszczonej i masę roztworu. Pamiętaj, że masa roztworu to suma masy substancji rozpuszczonej i masy rozpuszczalnika: mr = ms + mw, gdzie mw to masa wody. Znając stężenie procentowe i masę roztworu, możemy obliczyć masę substancji rozpuszczonej lub masę rozpuszczalnika. To ważne umiejętności, które często przydają się na sprawdzianach.
Praktyczne Zastosowania
Woda i roztwory wodne mają bardzo szerokie zastosowanie w życiu codziennym i w przemyśle. Używamy ich do gotowania, sprzątania, mycia, a także w wielu procesach produkcyjnych. W przemyśle spożywczym roztwory wodne są wykorzystywane do produkcji napojów, soków, konserw i innych produktów. W medycynie roztwory wodne soli fizjologicznej są używane do nawadniania organizmu i podawania leków.
Znajomość właściwości wody i roztworów wodnych jest bardzo ważna nie tylko w chemii, ale także w innych dziedzinach nauki, takich jak biologia, fizyka i geologia. Dzięki temu, że rozumiemy, jak woda się zachowuje i jak tworzy roztwory, możemy lepiej zrozumieć świat wokół nas i wykorzystywać te informacje w praktyce.
Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć zagadnienia związane z wodą i roztworami wodnymi. Powodzenia na sprawdzianie!