Cześć! Przygotowujemy się do sprawdzianu z chemii o budowie atomu. Nie martw się, razem damy radę!
Podstawowe Pojęcia
Atom
Atom to podstawowy składnik materii. Jest niezwykle mały.
Pamiętaj, że atomy składają się z jeszcze mniejszych cząstek.
Jądro Atomowe
W centrum atomu znajduje się jądro atomowe. Jest ono bardzo małe, ale skupia prawie całą masę atomu.
Jądro atomowe składa się z protonów i neutronów.
Protony
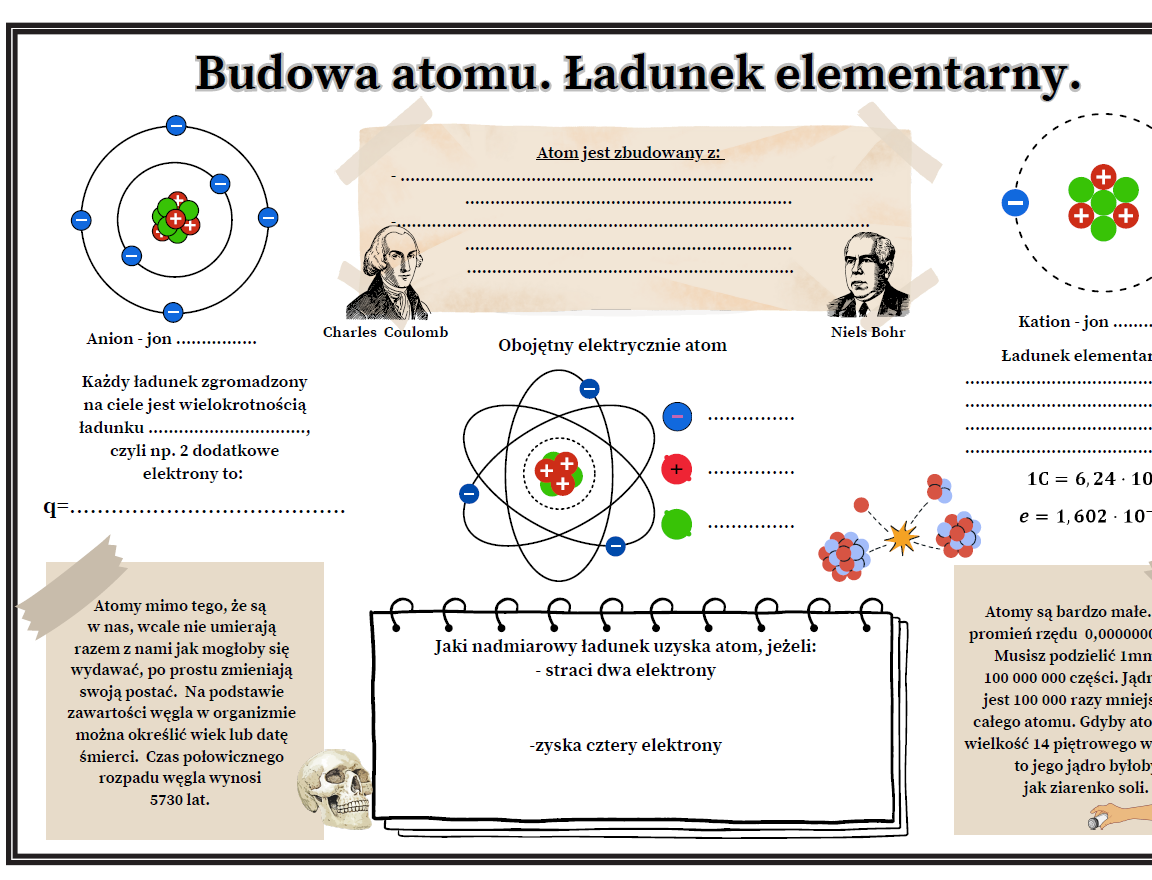
Protony to cząstki o ładunku dodatnim (+1). Liczba protonów w jądrze atomowym określa liczbę atomową (Z). To bardzo ważne!
Liczba atomowa (Z) identyfikuje pierwiastek chemiczny. Na przykład, każdy atom węgla ma 6 protonów.
Neutrony
Neutrony to cząstki obojętne elektrycznie (ładunek 0). Neutrony również znajdują się w jądrze atomowym.
Masa neutronu jest bardzo podobna do masy protonu.
Atomy tego samego pierwiastka mogą mieć różną liczbę neutronów. Nazywamy je izotopami.
Elektrony
Elektrony to cząstki o ładunku ujemnym (-1). Krążą one wokół jądra atomowego po orbitalach.
Masa elektronu jest bardzo mała w porównaniu z masą protonu i neutronu.
W atomie obojętnym liczba protonów jest równa liczbie elektronów.
Liczby Charakterystyczne Atomu
Liczba Atomowa (Z)
Liczba atomowa (Z) to liczba protonów w jądrze atomowym. Jest to unikalna cecha każdego pierwiastka.
Tożsamość pierwiastka jest zdefiniowana przez liczbę atomową (Z).
Liczba Masowa (A)
Liczba masowa (A) to suma liczby protonów i neutronów w jądrze atomowym. Czyli A = Z + N, gdzie N to liczba neutronów.
Liczba masowa (A) jest przybliżeniem masy atomowej danego izotopu.
Izotopy
Izotopy to atomy tego samego pierwiastka (ta sama liczba atomowa Z), ale o różnej liczbie neutronów (różna liczba masowa A).
Na przykład, węgiel-12 (12C) i węgiel-14 (14C) to izotopy węgla.
Wszystkie izotopy danego pierwiastka mają te same właściwości chemiczne.
Orbital Atomowy i Konfiguracja Elektronowa
Orbital Atomowy
Orbital atomowy to obszar wokół jądra atomowego, w którym prawdopodobieństwo znalezienia elektronu jest największe.
Orbitale mają różne kształty i energie.
Rozróżniamy orbitale typu s, p, d i f.
Konfiguracja Elektronowa
Konfiguracja elektronowa to rozmieszczenie elektronów na poszczególnych orbitalach w atomie.
Podczas zapisywania konfiguracji elektronowej stosujemy pewne reguły, np. zasadę Pauliego i regułę Hunda.
Zapis konfiguracji elektronowej pozwala przewidzieć właściwości chemiczne pierwiastka.
Przykład: Konfiguracja elektronowa tlenu (O) to 1s22s22p4.
Zasada Pauliego
Zasada Pauliego mówi, że na jednym orbitalu mogą znajdować się maksymalnie dwa elektrony, różniące się spinem.
Mówimy o parach elektronowych o przeciwnych spinach.
Reguła Hunda
Reguła Hunda mówi, że elektrony obsadzają orbitale o tej samej energii pojedynczo, zanim zaczną się parować.
Elektrony w obrębie podpowłoki dążą do maksymalnej liczby niesparowanych spinów.
Jony
Jon to atom, który utracił lub zyskał elektrony. W wyniku tego ma ładunek elektryczny.
Kationy
Kationy to jony o ładunku dodatnim. Powstają, gdy atom traci elektrony.
Na przykład, Na+ to kation sodu.
Aniony
Aniony to jony o ładunku ujemnym. Powstają, gdy atom zyskuje elektrony.
Na przykład, Cl- to anion chlorkowy.
Promieniotwórczość
Niektóre jądra atomowe są niestabilne i ulegają rozpadowi promieniotwórczemu. Podczas tego procesu emitują cząstki lub promieniowanie.
Istnieją różne rodzaje rozpadu promieniotwórczego, np. alfa, beta i gamma.
Promieniotwórczość ma wiele zastosowań, m.in. w medycynie i archeologii.
Podsumowanie
Pamiętaj o:
- Atom składa się z jądra atomowego (protonów i neutronów) i elektronów.
- Liczba atomowa (Z) określa liczbę protonów.
- Liczba masowa (A) to suma liczby protonów i neutronów.
- Izotopy to atomy tego samego pierwiastka o różnej liczbie neutronów.
- Orbital atomowy to obszar, w którym prawdopodobieństwo znalezienia elektronu jest największe.
- Konfiguracja elektronowa opisuje rozmieszczenie elektronów na orbitalach.
- Jon to atom, który utracił lub zyskał elektrony.
- Promieniotwórczość to proces rozpadu niestabilnych jąder atomowych.
Powodzenia na sprawdzianie! Jesteś dobrze przygotowany!