Hej! Gotowi na sprawdzian z Wody i Roztworów Wodnych w klasie 7? Nie martw się! Przejdziemy przez wszystko krok po kroku.
Woda – niezwykła substancja
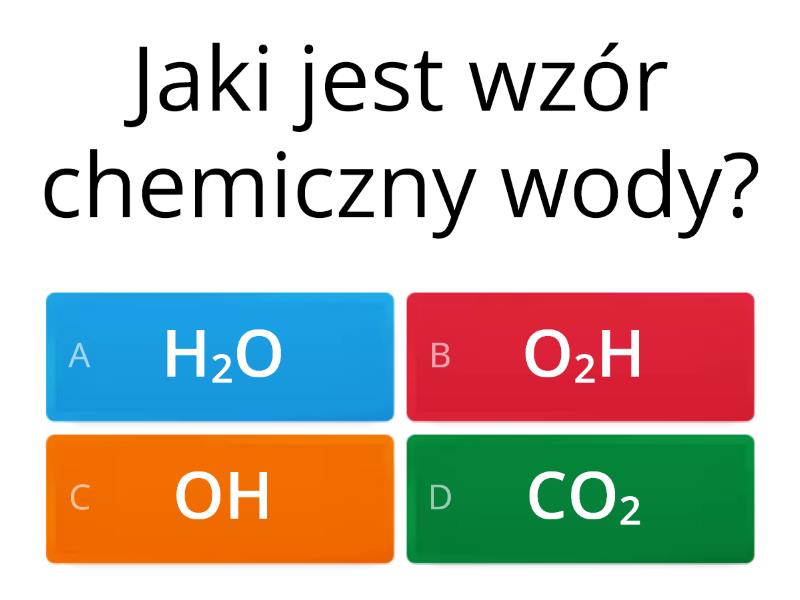
Woda (H2O) to podstawa życia. Pamiętaj o tym!
Woda występuje w trzech stanach skupienia: stałym (lód), ciekłym (woda) i gazowym (para wodna). Znasz je, prawda?
Krążenie wody w przyrodzie to ważny proces. Obejmuje parowanie, kondensację, opady i spływ.
Właściwości wody
Woda ma wiele unikalnych właściwości. To ważne!
Wysokie ciepło właściwe: oznacza to, że woda potrzebuje dużo energii, żeby się ogrzać lub ochłodzić. Dzięki temu temperatura na Ziemi jest stabilna.
Napięcie powierzchniowe: powoduje, że powierzchnia wody zachowuje się jak elastyczna błona. Dzięki temu owady mogą chodzić po wodzie.
Gęstość: gęstość wody jest najwyższa w temperaturze 4°C. Lód jest mniej gęsty niż woda, dlatego pływa.
Rozpuszczalnik: woda jest doskonałym rozpuszczalnikiem dla wielu substancji. Dzięki temu woda transportuje substancje odżywcze w organizmach i środowisku.
Roztwory Wodne
Roztwór to mieszanina jednorodna dwóch lub więcej substancji.
Rozpuszczalnik to substancja, w której rozpuszcza się inna substancja. Zazwyczaj jest to woda.
Substancja rozpuszczana to substancja, która rozpuszcza się w rozpuszczalniku.
Rodzaje roztworów
Rozróżniamy roztwory nasycone i nienasycone.
Roztwór nasycony: to roztwór, w którym w danej temperaturze nie można już rozpuścić więcej substancji.
Roztwór nienasycony: to roztwór, w którym można jeszcze rozpuścić więcej substancji.
Rozpuszczalność: to maksymalna ilość substancji, która może się rozpuścić w danej ilości rozpuszczalnika w określonej temperaturze.
Stężenie procentowe roztworu
Stężenie procentowe (Cp) określa, ile gramów substancji rozpuszczonej znajduje się w 100 gramach roztworu. Wzór na stężenie procentowe:
Cp = (masa substancji / masa roztworu) * 100%
Pamiętaj o jednostkach! Masa substancji i masa roztworu muszą być w tych samych jednostkach (np. gramach).
Obliczanie stężenia procentowego
Przećwiczmy kilka przykładów. To pomoże!
Przykład 1: Rozpuszczono 20 g cukru w 80 g wody. Oblicz stężenie procentowe roztworu.
Masa substancji (cukru) = 20 g
Masa rozpuszczalnika (wody) = 80 g
Masa roztworu = masa substancji + masa rozpuszczalnika = 20 g + 80 g = 100 g
Cp = (20 g / 100 g) * 100% = 20%
Przykład 2: Ile gramów soli należy rozpuścić w 150 g wody, aby otrzymać roztwór 10%?
Cp = 10%
Masa rozpuszczalnika (wody) = 150 g
Cp = (masa substancji / masa roztworu) * 100%
10% = (masa substancji / (masa substancji + 150 g)) * 100%
Po przekształceniach: masa substancji = 16,67 g (w przybliżeniu)
Rozpuszczanie substancji
Na szybkość rozpuszczania wpływa kilka czynników.
Temperatura: zazwyczaj, im wyższa temperatura, tym szybciej rozpuszcza się substancja. Ale nie zawsze!
Mieszanie: mieszanie przyspiesza rozpuszczanie. Pomaga rozproszyć substancję w rozpuszczalniku.
Rozdrobnienie substancji: im mniejsze cząstki substancji, tym szybciej się rozpuszczają. Dlatego cukier puder rozpuszcza się szybciej niż cukier kryształ.
Zastosowania roztworów wodnych
Roztwory wodne są bardzo ważne w życiu codziennym i w przemyśle.
Przemysł spożywczy: przygotowywanie napojów, konserwowanie żywności.
Medycyna: przygotowywanie leków, roztwory infuzyjne.
Rolnictwo: nawożenie roślin, przygotowywanie roztworów do oprysków.
Gospodarstwo domowe: pranie, sprzątanie.
Podsumowanie
Pamiętaj!
Woda to niezwykła substancja o unikalnych właściwościach. Znałeś je wszystkie?
Roztwory wodne to mieszaniny jednorodne. Rozumiesz różnicę między roztworem nasyconym i nienasyconym?
Stężenie procentowe to ważny parametr roztworu. Potrafisz je obliczyć?
Czynniki wpływające na rozpuszczanie to: temperatura, mieszanie i rozdrobnienie substancji.
Zastosowania roztworów wodnych są bardzo szerokie.
Powodzenia na sprawdzianie! Jesteś świetny i dasz radę!