Chemia w pierwszej klasie liceum to fundament dla dalszej nauki. Często na jej początku pojawia się "Sprawdzian To Nest Chemia 1 Liceum". Ten sprawdzian weryfikuje zrozumienie podstawowych koncepcji. Przyjrzyjmy się bliżej, czego możesz się spodziewać.
Budowa Atomu i Układ Okresowy
Pierwszym zagadnieniem jest budowa atomu. Obejmuje to zrozumienie, z czego składa się atom. Atom ma jądro, w którym znajdują się protony i neutrony. Wokół jądra krążą elektrony. Ważne jest, aby znać liczby atomowe i masowe.
Kolejny temat to układ okresowy pierwiastków. Układ okresowy porządkuje pierwiastki według rosnącej liczby atomowej. Grupy (kolumny) mają podobne właściwości chemiczne. Okresy (rzędy) pokazują zmiany w liczbie powłok elektronowych. Zrozumienie tej struktury pomaga przewidywać właściwości pierwiastków. Na przykład, metale alkaliczne (grupa 1) są bardzo reaktywne.
Wiązania Chemiczne
Wiązania chemiczne łączą atomy w cząsteczki. Istnieją różne rodzaje wiązań. Wiązanie kowalencyjne powstaje przez uwspólnianie elektronów. Wiązanie jonowe powstaje przez przekazywanie elektronów. Różnica elektroujemności decyduje o typie wiązania. Zrozumienie wiązań pozwala przewidzieć właściwości związków.
Elektroujemność to zdolność atomu do przyciągania elektronów w wiązaniu. Pierwiastki o dużej elektroujemności, jak fluor, silnie przyciągają elektrony. Różnice elektroujemności wpływają na polarność wiązań. Wiązania polarne mają częściowe ładunki dodatnie i ujemne. Na przykład, woda (H₂O) jest cząsteczką polarną.
Reakcje Chemiczne i Stechiometria
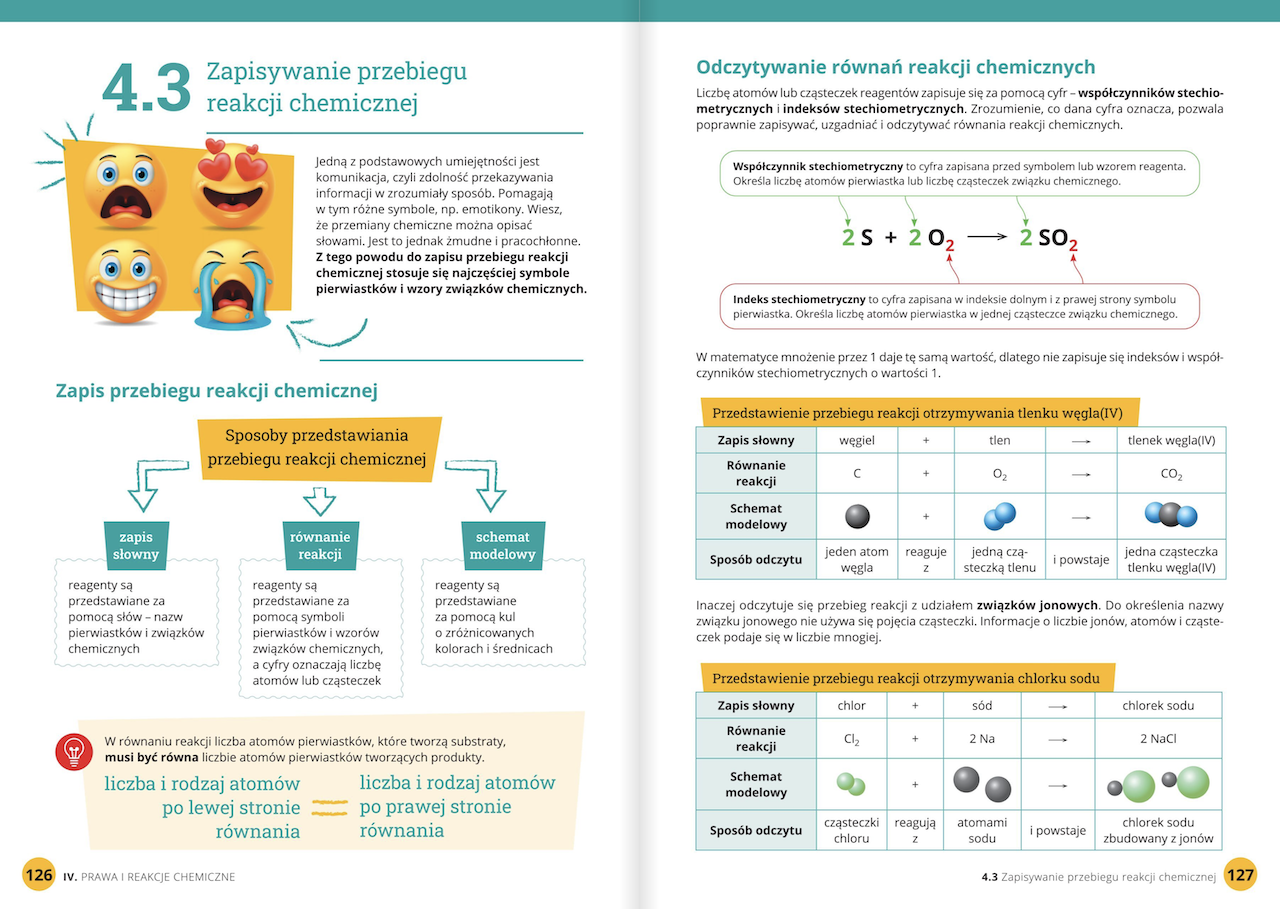
Reakcje chemiczne to procesy, w których związki chemiczne przekształcają się w inne. Trzeba umieć zapisywać i bilansować równania reakcji. Bilansowanie równań zapewnia zgodność z prawem zachowania masy. To znaczy, że liczba atomów każdego pierwiastka jest taka sama po obu stronach równania.
Stechiometria to dział chemii zajmujący się ilościowymi aspektami reakcji. Wykorzystuje się równania reakcji do obliczania ilości reagentów i produktów. Trzeba umieć przeliczać mole na gramy i odwrotnie. Często używa się do tego masy molowej. Masy molowe pierwiastków odczytuje się z układu okresowego. Przykładowo, masa molowa wody (H₂O) to około 18 g/mol.
Stężenia Roztworów
Stężenia roztworów opisują ilość substancji rozpuszczonej w roztworze. Popularne jednostki to stężenie procentowe i molowe. Stężenie procentowe to masa substancji rozpuszczonej w 100 gramach roztworu. Stężenie molowe to liczba moli substancji rozpuszczonej w 1 litrze roztworu.
Obliczenia stężeń wymagają użycia odpowiednich wzorów. Na przykład, aby obliczyć stężenie molowe, dzielimy liczbę moli substancji przez objętość roztworu w litrach. Rozumienie stężeń jest kluczowe w laboratorium chemicznym. Pozwala przygotowywać roztwory o określonych właściwościach.
Podsumowanie
Przygotowanie do "Sprawdzian To Nest Chemia 1 Liceum" wymaga powtórzenia omówionych zagadnień. Skup się na zrozumieniu podstaw. Ćwicz rozwiązywanie zadań. Powodzenia!
![Sprawdzian To Nest Chemia 1 Liceum - [Zestaw] To jest chemia 1 Podręcznik zakres podstawowy + To jest chemia](https://selkar.pl/img/product_media/693001-694000/Chemia_pakiet.jpg?1565704042)





![Sprawdzian To Nest Chemia 1 Liceum - [Zestaw] To jest chemia 1 Chemia ogólna i nieorganiczna Podręcznik](https://selkar.pl/img/product_media/695001-696000/maturalnekartypracychemia.JPG?1567412544)