Cześć! Porozmawiamy dzisiaj o Sprawdzianie Substancje i Ich Przemiany Nowa Era. To ważny temat w chemii, który pomoże Ci zrozumieć, jak materia otaczająca nas zmienia się i przekształca.
Substancje: Podstawowe Pojęcia
Zacznijmy od podstaw. Czym właściwie jest substancja? To materia o określonych właściwościach, takich jak temperatura wrzenia, temperatura topnienia czy gęstość. Substancje mogą być proste, jak żelazo (Fe) czy tlen (O2), lub złożone, jak woda (H2O) czy sól kuchenna (NaCl).
Rozróżniamy substancje proste, czyli pierwiastki, zbudowane z atomów jednego rodzaju (np. węgiel, siarka), oraz substancje złożone, czyli związki chemiczne, zbudowane z atomów różnych pierwiastków połączonych wiązaniami chemicznymi (np. dwutlenek węgla, amoniak).
Ważne jest zrozumienie różnicy między mieszaniną a związkiem chemicznym. Mieszanina to połączenie dwóch lub więcej substancji, które nie reagują ze sobą chemicznie. Składniki mieszaniny zachowują swoje indywidualne właściwości i można je rozdzielić metodami fizycznymi. Przykłady mieszanin to powietrze, mleko, czy sól z piaskiem. Związek chemiczny natomiast powstaje w wyniku reakcji chemicznej i ma zupełnie inne właściwości niż pierwiastki, z których się składa.
Właściwości Substancji
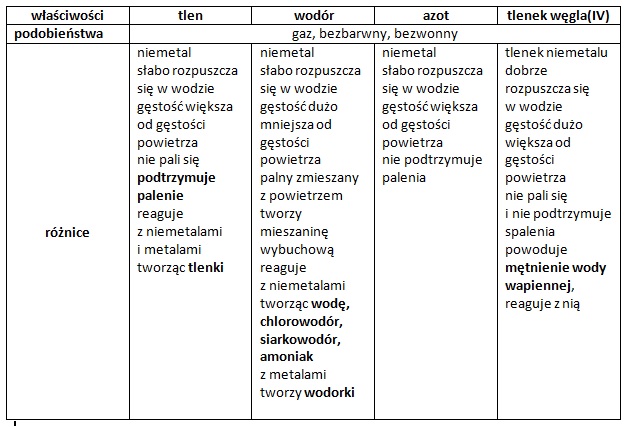
Każda substancja charakteryzuje się specyficznymi właściwościami fizycznymi i chemicznymi. Właściwości fizyczne to cechy, które możemy zaobserwować lub zmierzyć bez zmiany składu chemicznego substancji. Przykłady to barwa, zapach, gęstość, rozpuszczalność, temperatura wrzenia i temperatura topnienia. Obserwując lód topiący się w wodę, widzimy zmianę stanu skupienia, ale woda pozostaje wodą (H2O).
Właściwości chemiczne opisują zdolność substancji do reagowania z innymi substancjami i tworzenia nowych substancji. Przykłady to palność, korozyjność, reaktywność z kwasami. Na przykład, żelazo rdzewieje w obecności tlenu i wody, tworząc rdzę – nową substancję o innych właściwościach.
Przemiany Substancji
Przemiana fizyczna to zmiana stanu skupienia, kształtu lub objętości substancji, ale bez zmiany jej składu chemicznego. Typowe przemiany fizyczne to topnienie (ciało stałe w ciecz), krzepnięcie (ciecz w ciało stałe), parowanie (ciecz w gaz), skraplanie (gaz w ciecz), sublimacja (ciało stałe w gaz) i resublimacja (gaz w ciało stałe). Gotowanie wody to przykład parowania – woda zmienia się w parę wodną, ale nadal pozostaje H2O.
Przemiana chemiczna, zwana także reakcją chemiczną, to proces, w którym substancje (substraty) przekształcają się w nowe substancje (produkty) o innych właściwościach. Podczas reakcji chemicznej dochodzi do zmiany w sposobie powiązania atomów, a więc tworzą się nowe wiązania chemiczne. Przykłady reakcji chemicznych to spalanie (np. drewna), rdzewienie (żelaza), fermentacja (cukrów), synteza (np. amoniaku). Spalanie drewna powoduje powstanie popiołu, dwutlenku węgla i wody – substancji zupełnie innych niż drewno.
Rodzaje Reakcji Chemicznych
Reakcje chemiczne można klasyfikować na różne sposoby. Jednym z podziałów jest podział na reakcje syntezy, reakcje analizy, reakcje wymiany pojedynczej i reakcje wymiany podwójnej. Reakcja syntezy to połączenie dwóch lub więcej substancji w jedną substancję złożoną (A + B → AB). Reakcja analizy (rozkładu) to rozkład jednej substancji złożonej na dwie lub więcej prostszych substancji (AB → A + B). Reakcja wymiany pojedynczej to reakcja, w której jeden pierwiastek zastępuje inny pierwiastek w związku chemicznym (A + BC → AC + B). Reakcja wymiany podwójnej to reakcja, w której dwa związki chemiczne wymieniają się jonami (AB + CD → AD + CB).
Inny podział reakcji to podział na reakcje egzoenergetyczne i reakcje endoenergetyczne. Reakcja egzoenergetyczna to reakcja, w której energia jest uwalniana do otoczenia, najczęściej w postaci ciepła (np. spalanie). Reakcja endoenergetyczna to reakcja, w której energia jest pobierana z otoczenia (np. fotosynteza).
Prawo Zachowania Mas
Podstawowym prawem chemii jest prawo zachowania masy, które mówi, że masa substratów jest równa masie produktów reakcji chemicznej. Innymi słowy, w zamkniętym układzie masa nie powstaje ani nie ginie podczas reakcji chemicznej. Prawo to ma fundamentalne znaczenie w stechiometrii, czyli obliczeniach związanych z ilościami reagentów i produktów w reakcjach chemicznych.
Przykłady i Zastosowania
Zrozumienie substancji i ich przemian ma ogromne znaczenie w wielu dziedzinach życia. W przemyśle wykorzystuje się reakcje chemiczne do produkcji leków, tworzyw sztucznych, nawozów i wielu innych produktów. W medycynie wiedza o właściwościach substancji pozwala na diagnozowanie i leczenie chorób. W kuchni zachodzą liczne przemiany chemiczne podczas gotowania i pieczenia. Na przykład, pieczenie ciasta to złożony proces, w którym zachodzą reakcje między mąką, cukrem, jajkami i innymi składnikami, prowadzące do powstania nowego produktu o zupełnie innych właściwościach.
Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć podstawowe pojęcia związane z substancjami i ich przemianami. Pamiętaj, że chemia to fascynująca dziedzina, która pozwala nam zrozumieć świat wokół nas. Powodzenia na sprawdzianie!