Wprowadzenie do Reakcji Chemicznych – Sprawdzian dla Licealistów
Cześć! Przygotowujesz się do sprawdzianu z reakcji chemicznych? Super! Wyobraź sobie chemię jako wielką kuchnię. Reakcje chemiczne to po prostu przepisy, a atomy to składniki.
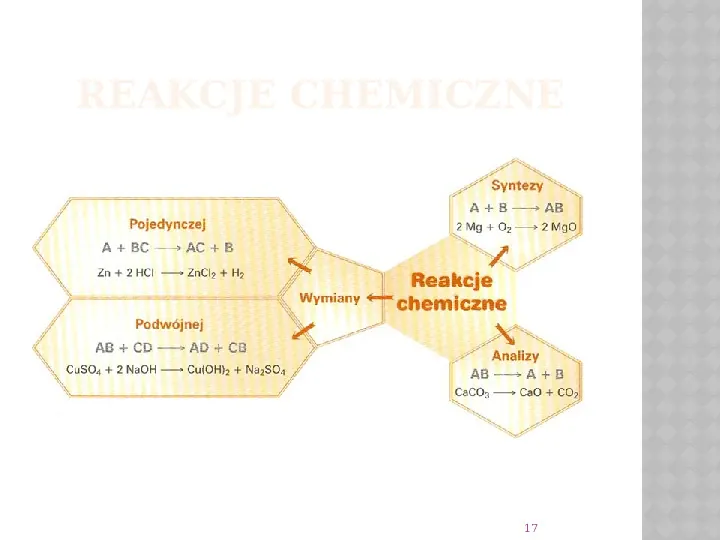
Rodzaje Reakcji – Porównanie do Gotowania
Synteza (łączenie) to jak dodawanie składników do garnka, aby zrobić jedną potrawę. Dwa (lub więcej) składników łączy się w jeden nowy produkt. Przykład: węgiel (C) łączy się z tlenem (O2) tworząc dwutlenek węgla (CO2) – proste spalanie!
Analiza (rozkład) to odwrotność syntezy. Masz jedno danie, które rozkładasz na poszczególne składniki. Na przykład, woda (H2O) pod wpływem prądu elektrycznego rozkłada się na wodór (H2) i tlen (O2). Pomyśl o tym jak o rozbieraniu tortu na warstwy!
Wymiana to jak podmiana składników w przepisie. Masz dwa "dania", które wymieniają się częściami. Na przykład, reakcja metali z kwasami: cynk (Zn) "kradnie" chlor (Cl) z kwasu solnego (HCl), tworząc chlorek cynku (ZnCl2), a wodór (H) uwalnia się w postaci gazu.
Wymiana podwójna to jeszcze bardziej skomplikowana wymiana. Dwa "dania" zamieniają się składnikami. Myśl o tym jak o tańcu, gdzie pary się zamieniają! Przykład: Reakcja roztworu azotanu srebra (AgNO3) z roztworem chlorku sodu (NaCl) prowadzi do powstania nierozpuszczalnego chlorku srebra (AgCl), który wytrąca się w postaci osadu, i azotanu sodu (NaNO3).
Równania Reakcji – Jak Czytać Przepisy Chemiczne
Równanie reakcji to przepis napisany językiem chemicznym. Współczynniki stechiometryczne mówią nam, ile "porcji" każdego składnika potrzebujemy. Musisz "zbilansować" równanie, czyli upewnić się, że po obu stronach strzałki jest taka sama liczba każdego rodzaju atomu. To jak upewnienie się, że masz tyle samo składników na początku, co na końcu "gotowania".
Spójrzmy na przykład: 2H2 + O2 → 2H2O. Oznacza to, że potrzebujesz dwóch cząsteczek wodoru i jednej cząsteczki tlenu, aby otrzymać dwie cząsteczki wody. Zwróć uwagę na te małe liczby (indeksy dolne) mówiące ile atomów danego pierwiastka jest w cząsteczce.
Typy Reakcji – Zwróć Uwagę na Efekty!
Reakcje egzoenergetyczne to reakcje, które wydzielają energię, zazwyczaj w postaci ciepła lub światła. Pomyśl o płonącym ognisku! Spalanie to typowy przykład. Temperatura mieszaniny reakcyjnej rośnie.
Reakcje endoenergetyczne potrzebują energii, aby zajść. Pomyśl o gotowaniu jajka – potrzebujesz ciepła, żeby je ugotować. Temperatura mieszaniny reakcyjnej maleje.
Zapamiętaj!
Kluczem do sukcesu na sprawdzianie jest zrozumienie podstawowych pojęć. Ćwicz bilansowanie równań, rozpoznawanie typów reakcji i zapamiętywanie definicji. Pamiętaj o wizualizacji! Wyobraź sobie reakcje chemiczne jako procesy, które zachodzą na poziomie atomowym. Powodzenia!