Witaj w świecie kwasów! Dziś skupimy się na tym, co musisz wiedzieć na sprawdzian z chemii w ósmej klasie. Przygotuj się na podróż pełną definicji, właściwości i reakcji chemicznych. Zaczynamy!
Czym są kwasy?
Kwasy to związki chemiczne, które charakteryzują się pewnymi specyficznymi właściwościami. Najprościej mówiąc, są to substancje, które w roztworze wodnym uwalniają jony wodorowe (H+). To właśnie obecność tych jonów odpowiada za ich kwaśny smak i zdolność do reagowania z innymi substancjami.
Kwasy można rozpoznać po kilku cechach. Mają kwaśny smak, choć oczywiście nie należy ich próbować, zwłaszcza w laboratorium! Powodują zmiany barwy wskaźników, takich jak lakmus (czerwienieje w środowisku kwaśnym) czy oranż metylowy (również czerwienieje). Reagują z metalami, tworząc sole i wodór.
Podział kwasów
Kwasy dzielimy na kilka grup, biorąc pod uwagę różne kryteria. Najczęściej spotykany podział to podział ze względu na ich budowę. Wyróżniamy więc kwasy tlenowe i kwasy beztlenowe.
Kwasy beztlenowe to takie, które w swojej cząsteczce zawierają tylko wodór i niemetal. Przykładem jest kwas chlorowodorowy (HCl), zwany też kwasem solnym. Tworzy się go przez rozpuszczenie chlorowodoru w wodzie. Innym przykładem jest kwas fluorowodorowy (HF).
Kwasy tlenowe, oprócz wodoru, zawierają także tlen i niemetal. Typowym przykładem jest kwas siarkowy(VI) (H2SO4), bardzo ważny w przemyśle chemicznym. Inne przykłady to kwas azotowy(V) (HNO3) i kwas węglowy (H2CO3).
Wzory i nazewnictwo kwasów
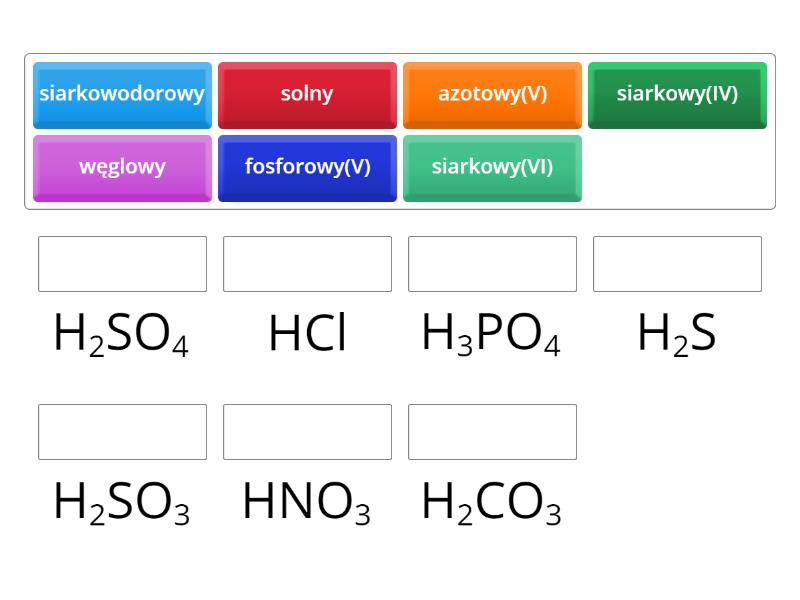
Pisanie wzorów i nazywanie kwasów to ważna umiejętność. W przypadku kwasów beztlenowych nazwa tworzona jest przez dodanie przedrostka "kwas" i nazwy niemetalu z końcówką "-owodorowy". Tak więc HCl to kwas chlorowodorowy.
Dla kwasów tlenowych sprawa jest nieco bardziej skomplikowana. Nazwa składa się z przedrostka "kwas", nazwy niemetalu i końcówki, która zależy od stopnia utlenienia niemetalu. Na przykład H2SO4 to kwas siarkowy(VI), gdzie (VI) oznacza stopień utlenienia siarki. Jeśli siarka miałaby stopień utlenienia (IV), byłby to kwas siarkowy(IV) (H2SO3).
Warto zapamiętać kilka popularnych kwasów i ich wzory: * Kwas chlorowodorowy (HCl) * Kwas siarkowy(VI) (H2SO4) * Kwas azotowy(V) (HNO3) * Kwas węglowy (H2CO3) * Kwas fosforowy(V) (H3PO4)
Właściwości kwasów
Kwasy wykazują szereg charakterystycznych właściwości. Są to między innymi:
- Kwaśny smak: Nie próbuj kwasów w laboratorium!
- Działanie żrące: Stężone kwasy mogą powodować poważne oparzenia.
- Zdolność do przewodzenia prądu elektrycznego: Kwasy w roztworach wodnych dysocjują na jony, co umożliwia przepływ prądu.
- Reakcje z metalami: Kwasy reagują z metalami, tworząc sole i wodór.
- Reakcje z zasadami (neutralizacja): Kwasy reagują z zasadami, tworząc sole i wodę.
- Zmiana barwy wskaźników: Lakmus czerwienieje, oranż metylowy czerwienieje, fenoloftaleina pozostaje bezbarwna.
Reakcje kwasów
Kwasy uczestniczą w wielu ważnych reakcjach chemicznych. Najważniejsze z nich to:
Reakcja z metalami: Kwas reaguje z metalem, tworząc sól i wodór. Na przykład: Zn + 2HCl → ZnCl2 + H2
Reakcja z tlenkami metali: Kwas reaguje z tlenkiem metalu, tworząc sól i wodę. Na przykład: CuO + H2SO4 → CuSO4 + H2O
Reakcja z wodorotlenkami (neutralizacja): Kwas reaguje z wodorotlenkiem, tworząc sól i wodę. Na przykład: NaOH + HCl → NaCl + H2O
Reakcja z solami: Kwas może reagować z solą, tworząc inny kwas i inną sól. Warunkiem jest, aby jeden z produktów reakcji był słabym kwasem lub osadem. Na przykład: CaCO3 + 2HCl → CaCl2 + H2CO3 Kwas węglowy rozkłada się na wodę i dwutlenek węgla: H2CO3 → H2O + CO2
Dysocjacja kwasów
Dysocjacja to proces rozpadu związku chemicznego na jony pod wpływem rozpuszczalnika, np. wody. Kwasy ulegają dysocjacji, tworząc jony wodorowe (H+) i aniony reszty kwasowej. Siła kwasu zależy od stopnia jego dysocjacji.
Kwasy mocne, takie jak kwas chlorowodorowy (HCl), dysocjują w wodzie prawie całkowicie. Oznacza to, że prawie wszystkie cząsteczki kwasu rozpadają się na jony. Kwasy słabe, takie jak kwas węglowy (H2CO3), dysocjują tylko w niewielkim stopniu.
Równanie dysocjacji kwasu chlorowodorowego wygląda następująco: HCl → H+ + Cl-
Równanie dysocjacji kwasu siarkowego(VI) zachodzi w dwóch etapach: H2SO4 → H+ + HSO4- HSO4- → H+ + SO42-
Zastosowanie kwasów
Kwasy znajdują szerokie zastosowanie w różnych dziedzinach życia. Oto kilka przykładów:
- Kwas siarkowy(VI) (H2SO4): Produkcja nawozów, tworzyw sztucznych, włókien syntetycznych, barwników, detergentów.
- Kwas azotowy(V) (HNO3): Produkcja nawozów, materiałów wybuchowych, tworzyw sztucznych.
- Kwas chlorowodorowy (HCl): Oczyszczanie metali, produkcja chlorków, w przemyśle spożywczym (np. do produkcji żelatyny). W żołądku wspomaga trawienie.
- Kwas octowy (CH3COOH): Produkcja octu spożywczego, tworzyw sztucznych, leków.
- Kwas fosforowy(V) (H3PO4): Produkcja nawozów, detergentów, w przemyśle spożywczym (np. jako regulator kwasowości).
To już wszystko, co najważniejsze o kwasach, co musisz wiedzieć na sprawdzian z chemii w ósmej klasie. Pamiętaj o powtarzaniu materiału i rozwiązywaniu zadań. Powodzenia!