Hej uczniowie! Gotowi na sprawdzian z kwasów? Nie bójcie się! Kwasy, choć brzmią groźnie, są wszędzie wokół nas, a zrozumienie ich to naprawdę pestka, szczególnie jeśli myślimy o nich obrazowo.
Co to właściwie jest ten kwas?
Wyobraźcie sobie, że macie atom wodoru (H), czyli taką malutką piłeczkę. Teraz wyobraźcie sobie drużynę, która bardzo chce te piłeczki zabierać. Tą drużyną są kwasy! Kwas to substancja, która w wodzie oddaje jony wodoru (H+). Czyli oddaje te nasze małe piłeczki H. Im więcej odda, tym mocniejszy kwas!
Pomyśl o soku z cytryny. Jest kwaśny, prawda? To dlatego, że zawiera kwas cytrynowy. Kwas cytrynowy oddaje jony wodoru do wody (soku), dając nam charakterystyczny kwaśny smak.
Jak to zapamiętać wizualnie?
Narysuj sobie słoik z napisem "KWAS". Wrzucaj do niego małe piłeczki (H+). Im więcej piłeczek w słoiku, tym "bardziej kwaśny" napis na słoiku jest wyrazisty!
Podział kwasów: tlenowe i beztlenowe
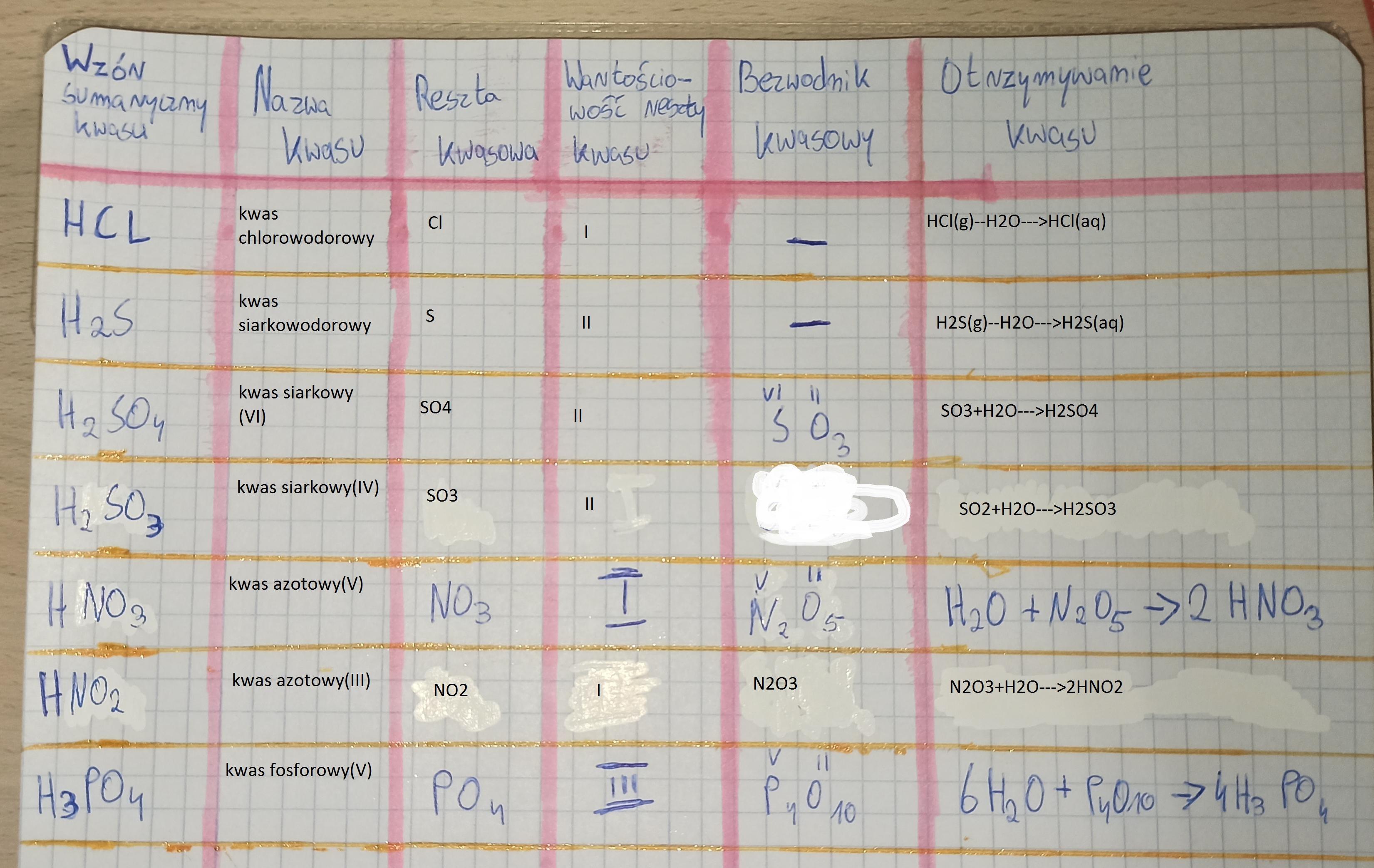
Teraz trochę klasyfikacji. Kwasy dzielimy na tlenowe i beztlenowe. Różnica jest prosta: patrzymy, czy w cząsteczce kwasu jest tlen (O). Jeśli jest – kwas jest tlenowy. Jeśli nie ma – kwas jest beztlenowy.
Kwasy beztlenowe: Składają się z atomów wodoru (H) i atomów niemetali, ale bez tlenu. Przykład: kwas solny (HCl). To popularny kwas w żołądku! Pomaga trawić jedzenie. Wyobraź sobie, że kwas solny to taki mały "pacman", który połyka cząsteczki jedzenia. Pacman składa się tylko z wodoru i chloru. Bez tlenu!
Kwasy tlenowe: Składają się z atomów wodoru (H), tlenu (O) i atomów niemetali. Przykład: kwas siarkowy (H2SO4). Jest to jeden z najważniejszych kwasów przemysłowych. Wyobraź sobie kwas siarkowy jako "super bohatera" chemii – używany do wielu różnych rzeczy! Ale ten super bohater ma w swoim składzie wodór, siarkę i tlen!
Wizualna ściąga:
Narysuj tabelkę. Po jednej stronie napisz "Kwasy Beztlenowe", po drugiej "Kwasy Tlenowe". Pod "Beztlenowe" narysuj Pacmana (H i Cl). Pod "Tlenowe" narysuj Super Bohatera (H, S i O).
Właściwości kwasów – co warto zapamiętać?
Kwasy mają kilka charakterystycznych właściwości, które pomogą Ci je rozpoznać:
- Smak: Kwasy mają kwaśny smak (ale nigdy nie próbuj kwasów w laboratorium!). Pomyśl o cytrynie, occie (kwas octowy) – to wszystko zasługa kwasów.
- Reakcja z metalami: Kwasy reagują z niektórymi metalami, tworząc sole i wydzielając wodór (H2). Wyobraź sobie, że kwas atakuje metal i wyskakują z niego bąbelki wodoru!
- Działanie na wskaźniki: Kwasy zmieniają barwę wskaźników. Najpopularniejszy wskaźnik to papier lakmusowy. W kwasach papier lakmusowy staje się czerwony. Pomyśl o czerwonym świetle "STOP" – kwas ostrzega, żeby uważać!
- Reakcja z zasadami (neutralizacja): Kwasy reagują z zasadami, tworząc sól i wodę. To tak jakby kwas i zasada się "znosiły" – neutralizowały swoje właściwości. Wyobraź sobie dwie puzzle, które idealnie do siebie pasują. Kwas i zasada – razem tworzą coś neutralnego.
Wizualizacja właściwości:
Narysuj cztery małe obrazki:
- Usta, które krzywią się z kwaśnego smaku (ALE pamiętaj, że nie wolno próbować kwasów w laborku!).
- Metal, z którego wydobywają się bąbelki (wodór).
- Papier lakmusowy zmieniający kolor na czerwony.
- Dwie puzzle, które idealnie do siebie pasują.
Stężenie kwasów – co to oznacza?
Stężenie kwasu mówi nam, ile kwasu jest rozpuszczone w danym roztworze. Im więcej kwasu, tym wyższe stężenie i tym silniejsze działanie. Wyobraź sobie sok cytrynowy. Jeśli dodasz więcej cytryny do wody, sok będzie bardziej kwaśny, prawda? Podobnie jest z kwasami – im więcej kwasu, tym mocniejszy roztwór.
Kwas stężony to taki, w którym jest dużo kwasu i mało wody. Kwas rozcieńczony to taki, w którym jest mało kwasu i dużo wody.
Proste porównanie:
Narysuj dwa słoiki. W jednym słoiku (kwas stężony) narysuj dużo małych piłeczek (cząsteczek kwasu) i mało wody. W drugim słoiku (kwas rozcieńczony) narysuj mało piłeczek i dużo wody.
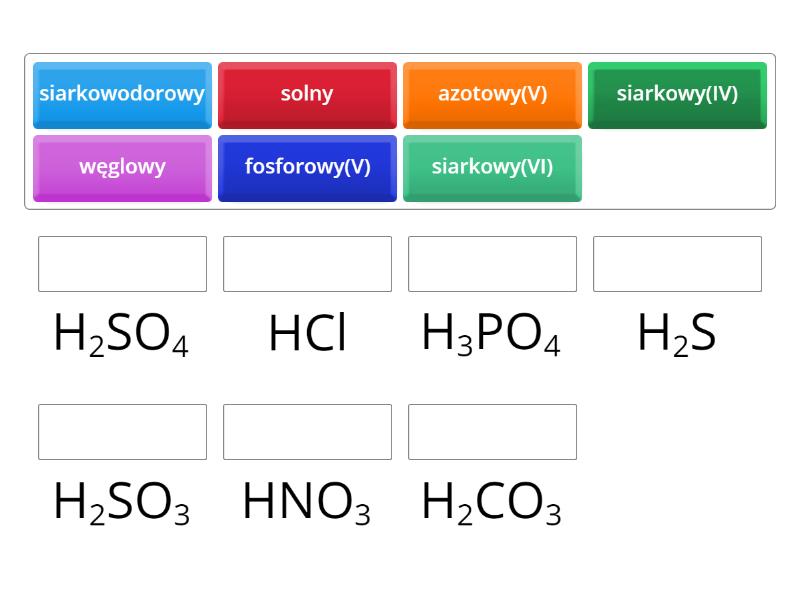
Najważniejsze kwasy, które musisz znać:
- Kwas solny (HCl) – w żołądku, do trawienia.
- Kwas siarkowy (H2SO4) – w przemyśle, akumulatorach.
- Kwas azotowy (HNO3) – w nawozach, materiałach wybuchowych.
- Kwas fosforowy (H3PO4) – w nawozach, napojach (np. Coca-Cola).
- Kwas octowy (CH3COOH) – w occie, konserwant.
- Kwas węglowy (H2CO3) – w napojach gazowanych.
Spróbuj narysować małą ilustrację do każdego z tych kwasów, żeby łatwiej je zapamiętać! Na przykład: HCl – żołądek, H2SO4 – akumulator.
Mam nadzieję, że teraz kwasy nie będą już takie straszne! Pamiętaj, żeby używać wyobraźni i tworzyć własne wizualizacje. Powodzenia na sprawdzianie!