Hej ósmoklasisto! Gotowy na przygodę z chemią? Dziś zajmiemy się związkami węgla z wodorem. Mówimy o węglowodorach!
Czym są te węglowodory?
Wyobraź sobie węgiel (C) jako klocek LEGO. A wodór (H)? Mały, łączący element.
Węglowodory to po prostu "budowle" z tych klocków. Węgiel i wodór łączą się ze sobą na różne sposoby.
Pomyśl o tym jak o modelach samochodów. Możesz zbudować mały samochodzik (mała cząsteczka) lub duży autobus (duża cząsteczka). Wszystko zależy od liczby klocków!
Podział węglowodorów
Mamy różne rodzaje "modeli" węglowodorów. Podzielimy je na dwie główne grupy. Nasycone i nienasycone.
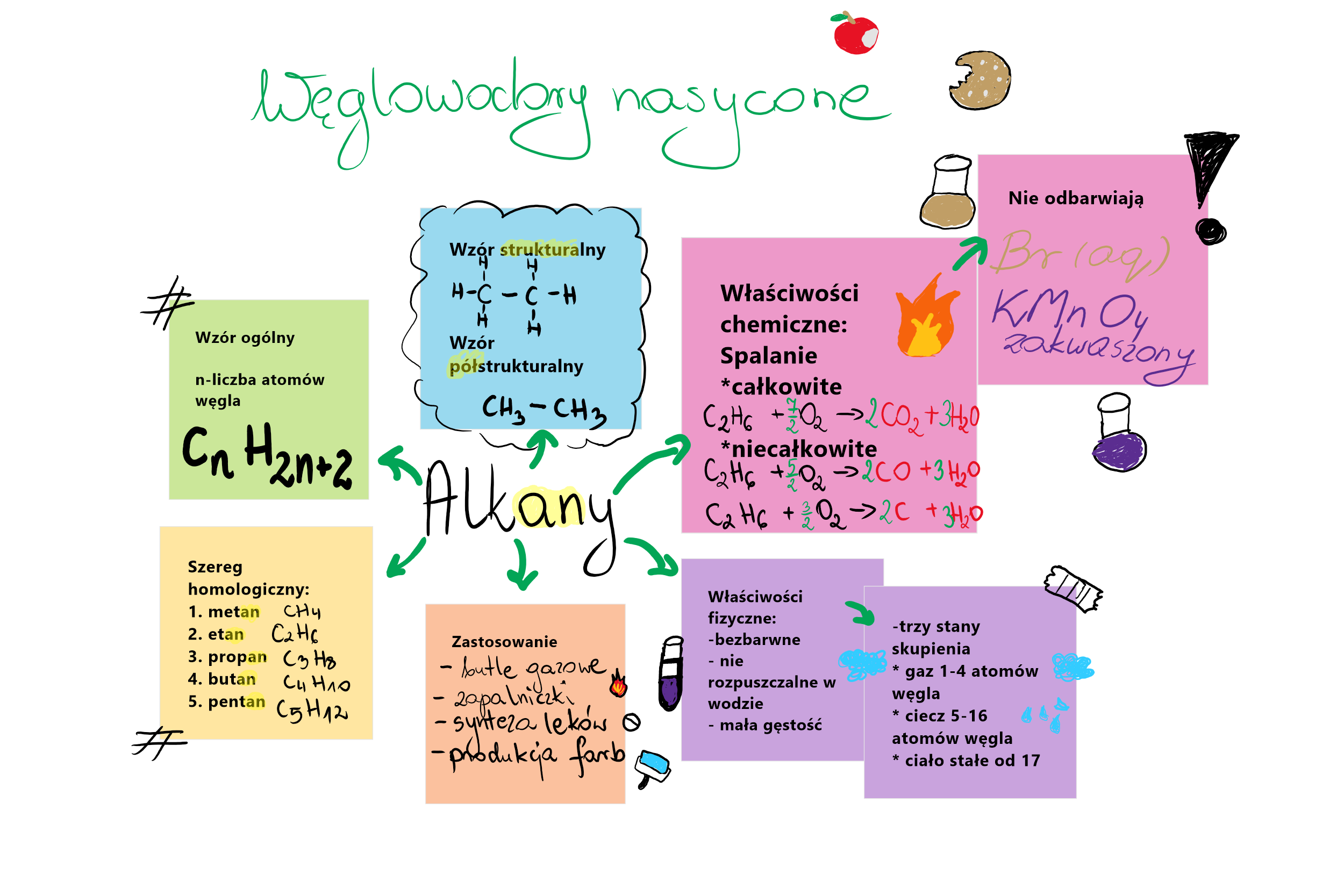
Węglowodory nasycone - alkany
To nasze "podstawowe" modele. Mają tylko pojedyncze połączenia między atomami węgla. To jak prosta linia LEGO klocków połączona tylko jednym elementem.
Ich nazwy kończą się na "-an". Na przykład metan, etan, propan, butan.
Metan (CH4) to najprostszy alkan. To gaz ziemny! Używamy go do ogrzewania domów.
Etan (C2H6) to kolejny gaz. W niewielkich ilościach występuje w gazie ziemnym.
Propan (C3H8) jest w butlach gazowych. Używamy go do kuchenek turystycznych.
Butan (C4H10) to gaz w zapalniczkach.
Zapamiętaj! Alkany to "pełne" węglowodory. Mają maksymalną liczbę atomów wodoru, jaką węgiel może związać.
Węglowodory nienasycone - alkeny i alkiny
Tutaj zaczyna się zabawa! Te węglowodory mają podwójne lub potrójne wiązania między atomami węgla. To jakby klocki LEGO były połączone dwoma lub trzema elementami!
Alkeny mają jedno wiązanie podwójne. Ich nazwy kończą się na "-en". Przykład: eten (C2H4), czyli etylen.
Etylen przyspiesza dojrzewanie owoców! Rolnicy go używają do szybszego dojrzewania bananów.
Alkiny mają jedno wiązanie potrójne. Ich nazwy kończą się na "-in". Przykład: etyn (C2H2), czyli acetylen.
Acetylen spala się bardzo gorącym płomieniem. Używa się go do spawania metali.
Węglowodory nienasycone są bardziej reaktywne niż alkany. To znaczy, że łatwiej wchodzą w reakcje chemiczne.
Właściwości węglowodorów
Węglowodory są palne. To znaczy, że mogą się spalać w obecności tlenu. Pamiętaj, ogień jest niebezpieczny!
Spalanie węglowodorów daje energię. Używamy tej energii do ogrzewania, gotowania i napędzania samochodów.
Im większa cząsteczka węglowodoru, tym wyższa temperatura wrzenia. Małe cząsteczki, jak metan, są gazami w temperaturze pokojowej. Duże, jak woski, są ciałami stałymi.
Węglowodory są nierozpuszczalne w wodzie. Olej i woda się nie mieszają! To dlatego, że węglowodory są hydrofobowe (boją się wody).
Zastosowania węglowodorów
Węglowodory są wszędzie! Są podstawą paliw, tworzyw sztucznych i wielu innych produktów.
Benzyna, olej napędowy i gaz ziemny to mieszaniny węglowodorów. Dają energię naszym samochodom i domom.
Plastiki są zrobione z polimerów. A polimery często powstają z węglowodorów!
Leki, kosmetyki i detergenty też często zawierają węglowodory.
Reakcje chemiczne węglowodorów
Węglowodory uczestniczą w wielu reakcjach chemicznych. Najważniejsza to spalanie.
Spalanie to reakcja z tlenem. Powstaje dwutlenek węgla (CO2) i woda (H2O).
Reakcja spalania metanu: CH4 + 2O2 → CO2 + 2H2O. To proste, prawda?
Węglowodory mogą też ulegać innym reakcjom, np. addycji (przyłączania atomów) do wiązań podwójnych lub potrójnych w alkenach i alkinach.
Podsumowanie
Węglowodory to związki węgla z wodorem. Są podstawą życia i przemysłu.
Pamiętaj o alkanach (pojedyncze wiązania), alkenach (jedno podwójne wiązanie) i alkinach (jedno potrójne wiązanie).
Zrozumienie węglowodorów otwiera drzwi do fascynującego świata chemii organicznej! Powodzenia na sprawdzianie!