Cześć! Gotowi na sprawdzian z chemii? Super! Skupimy się na wodzie i roztworach wodnych. Będzie dobrze, przejdźmy przez najważniejsze zagadnienia krok po kroku.
Woda – Niezwykły Związek
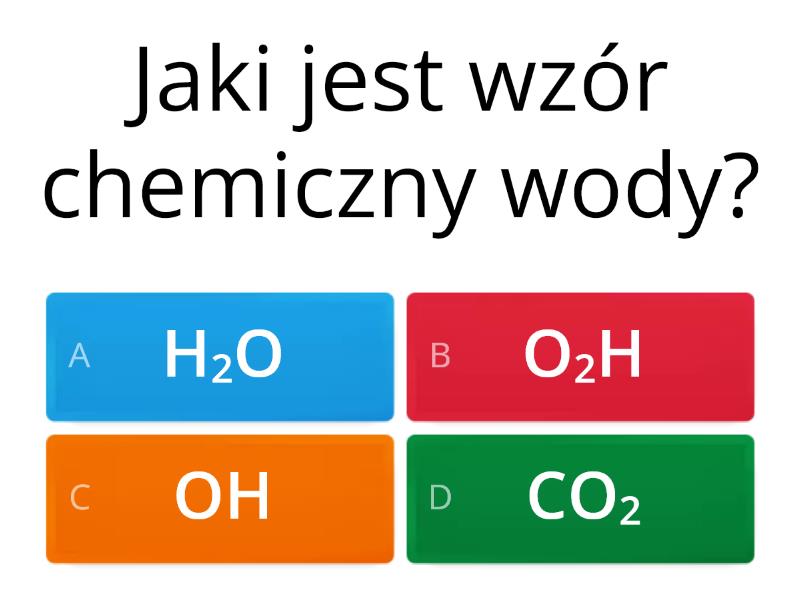
Woda (H2O) to podstawa życia. Bez niej nic by nie istniało, prawda?
Budowa cząsteczki wody
Cząsteczka wody składa się z jednego atomu tlenu i dwóch atomów wodoru. Te atomy łączą się wiązaniami kowalencyjnymi spolaryzowanymi.
Co to znaczy spolaryzowane? Tlen jest bardziej elektroujemny niż wodór. Przyciąga elektrony silniej. To sprawia, że tlen ma niewielki ładunek ujemny (δ-), a wodór niewielki ładunek dodatni (δ+).
Dzięki temu woda jest cząsteczką polarną. Pamiętajcie o tym!
Wiązania wodorowe
Cząsteczki wody "lubią się". Łączą się ze sobą wiązaniami wodorowymi.
Wiązanie wodorowe to słabe oddziaływanie między atomem wodoru jednej cząsteczki wody a atomem tlenu innej cząsteczki. Odpowiadają za wiele unikalnych właściwości wody.
Dzięki nim woda ma wysokie napięcie powierzchniowe. Innym przykładem jest relatywnie wysoka temperatura wrzenia i krzepnięcia.
Właściwości fizyczne wody
Woda występuje w trzech stanach skupienia: stałym (lód), ciekłym (woda) i gazowym (para wodna).
Gęstość wody jest najwyższa w temperaturze 4°C. Lód ma mniejszą gęstość niż woda. Dlatego unosi się na jej powierzchni. To bardzo ważne dla życia w zbiornikach wodnych!
Woda ma wysokie ciepło właściwe. Oznacza to, że potrzebuje dużo energii, żeby się ogrzać. Dzięki temu temperatura wody w jeziorach i oceanach zmienia się powoli.
Roztwory Wodne
Roztwór to mieszanina jednorodna dwóch lub więcej substancji.
Składniki roztworu
W roztworze mamy: rozpuszczalnik i substancję rozpuszczoną.
Rozpuszczalnik to substancja, która rozpuszcza inną substancję. Najczęściej jest to woda (dlatego mówimy o roztworach wodnych!).
Substancja rozpuszczona to substancja, która ulega rozpuszczeniu w rozpuszczalniku.
Rodzaje roztworów
Roztwory dzielimy na:
- Roztwory nienasycone: Można jeszcze rozpuścić więcej substancji.
- Roztwory nasycone: Nie można już rozpuścić więcej substancji w danej temperaturze.
- Roztwory przesycone: Zawierają więcej substancji rozpuszczonej niż roztwór nasycony w danej temperaturze. Są nietrwałe.
Jak sprawdzić, czy roztwór jest nasycony? Dodaj trochę substancji. Jeśli się rozpuści, to roztwór jest nienasycony. Jeśli nie – nasycony (albo przesycony, ale to trudniejsze do stwierdzenia).
Rozpuszczalność
Rozpuszczalność to maksymalna ilość substancji, którą można rozpuścić w danej ilości rozpuszczalnika w określonej temperaturze. Wyrażana jest zazwyczaj w gramach na 100g rozpuszczalnika.
Rozpuszczalność zależy od temperatury. Zazwyczaj rozpuszczalność ciał stałych rośnie wraz z temperaturą. Dla gazów jest odwrotnie – spada.
Wpływ na rozpuszczalność ma również rodzaj substancji i rozpuszczalnika. "Podobne rozpuszcza się w podobnym". Substancje polarne rozpuszczają się w rozpuszczalnikach polarnych (np. woda). Substancje niepolarne rozpuszczają się w rozpuszczalnikach niepolarnych.
Stężenie procentowe roztworu
Stężenie procentowe (Cp) informuje nas, ile gramów substancji rozpuszczono w 100 gramach roztworu.
Wzór na stężenie procentowe:
Cp = (masa substancji / masa roztworu) * 100%
Gdzie:
- masa substancji – masa substancji rozpuszczonej
- masa roztworu – masa substancji + masa rozpuszczalnika
Pamiętaj, żeby dobrze podstawiać do wzoru! Zawsze sprawdź, co masz podane w zadaniu.
Obliczenia związane z roztworami
Często trzeba obliczyć masę substancji lub masę rozpuszczalnika potrzebną do przygotowania roztworu o danym stężeniu procentowym.
Np. Jak przygotować 200g roztworu 10%? Musisz obliczyć, ile gramów substancji potrzebujesz.
10% = (masa substancji / 200g) * 100%
masa substancji = (10 * 200) / 100 = 20g
Czyli potrzebujesz 20g substancji i 180g wody (200g – 20g = 180g).
Podsumowanie
Pamiętaj najważniejsze pojęcia: woda jako związek polarny, wiązania wodorowe, rozpuszczalność, rodzaje roztworów, stężenie procentowe.
Poćwicz obliczenia związane ze stężeniem procentowym. Przerób zadania z podręcznika i zeszytu.
Powodzenia na sprawdzianie! Wierzę w Ciebie!