Witaj! Porozmawiajmy o węglowodorach. Skupimy się na alkanach, alkenach i alkinach. To ważne grupy związków organicznych w chemii.
Alkany: Węglowodory Nasycone
Alkany to najprostsze węglowodory. Zawierają tylko wiązania pojedyncze między atomami węgla. Są to związki nasycone, ponieważ każdy atom węgla jest związany z maksymalną liczbą atomów wodoru.
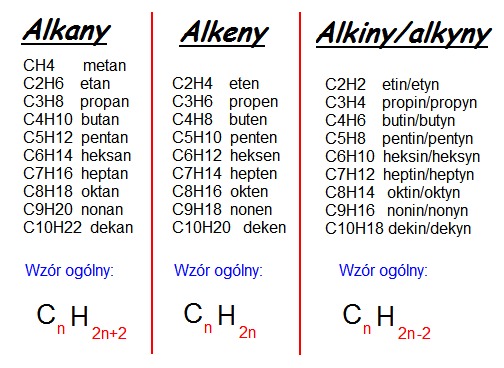
Wzór ogólny alkanów to CnH2n+2. "n" oznacza liczbę atomów węgla w cząsteczce. Przykładowo, metan (CH4) ma jeden atom węgla (n=1). Etan (C2H6) ma dwa atomy węgla (n=2). Propan (C3H8) ma trzy atomy węgla (n=3) i tak dalej.
Nazwy alkanów tworzymy dodając przyrostek "-an" do rdzenia wskazującego liczbę atomów węgla. Met-, et-, prop-, but- to rdzenie oznaczające odpowiednio 1, 2, 3 i 4 atomy węgla. Alkany charakteryzują się małą aktywnością chemiczną. Są dobrymi rozpuszczalnikami dla substancji organicznych. Używa się ich jako paliwa.
Alkeny: Węglowodory Nienasycone z Wiązaniem Podwójnym
Alkeny to węglowodory zawierające jedno wiązanie podwójne między atomami węgla. To wiązanie podwójne czyni je bardziej reaktywnymi niż alkany. Mówimy, że alkeny są nienasycone.
Wzór ogólny alkenów to CnH2n. Najprostszy alken to eten (C2H4), znany również jako etylen. Posiada on dwa atomy węgla połączone wiązaniem podwójnym. Kolejnym przykładem jest propen (C3H6), z trzema atomami węgla.
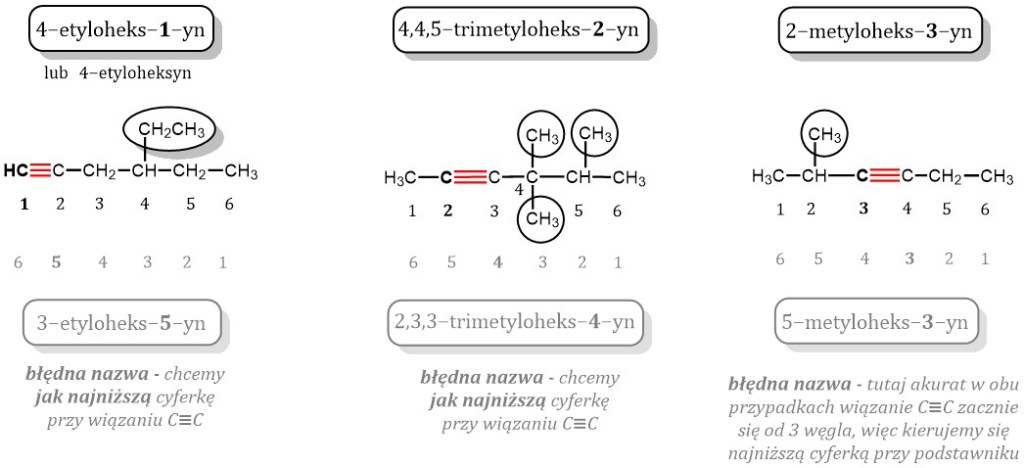
Nazwy alkenów tworzymy podobnie jak alkanów. Używamy jednak przyrostka "-en". Eten, propen, buten to przykłady. Położenie wiązania podwójnego jest ważne. Jeśli jest więcej niż jedno możliwe położenie, musimy je zaznaczyć numerem atomu węgla, od którego zaczyna się wiązanie podwójne. Na przykład but-1-en i but-2-en.
Alkeny są wykorzystywane do produkcji plastików (np. polietylenu z etenu). Służą także jako surowce w syntezie organicznej. Uczestniczą w reakcjach addycji, gdzie inne atomy lub grupy atomów przyłączają się do atomów węgla tworzących wiązanie podwójne.
Alkiny: Węglowodory Nienasycone z Wiązaniem Potrójnym
Alkiny to węglowodory zawierające jedno wiązanie potrójne między atomami węgla. Podobnie jak alkeny, są to związki nienasycone. Są one jeszcze bardziej reaktywne od alkenów, ze względu na obecność wiązania potrójnego.
Wzór ogólny alkinów to CnH2n-2. Najprostszym alkinem jest etyn (C2H2), znany również jako acetylen. Ma on dwa atomy węgla połączone wiązaniem potrójnym. Kolejny to propin (C3H4).
Nazwy alkinów tworzymy używając przyrostka "-in". Etyn, propin, butin to przykłady. Podobnie jak w alkenach, położenie wiązania potrójnego jest ważne. Musimy je zaznaczyć numerem atomu węgla, od którego zaczyna się wiązanie potrójne. Na przykład but-1-yn i but-2-yn.
Acetylen jest używany w palnikach acetylenowo-tlenowych do spawania i cięcia metali. Alkiny są także ważnymi surowcami w syntezie organicznej. Uczestniczą w reakcjach addycji, podobnie jak alkeny, ale często wymagają bardziej energicznych warunków.
Podsumowanie: Różnice i Podobieństwa
Alkany, alkeny i alkiny to trzy podstawowe klasy węglowodorów. Różnią się rodzajem wiązań między atomami węgla. Alkany mają tylko wiązania pojedyncze. Alkeny mają jedno wiązanie podwójne. Alkiny mają jedno wiązanie potrójne.
Ta różnica w wiązaniach wpływa na ich reaktywność chemiczną. Alkany są najmniej reaktywne. Alkeny i alkiny są bardziej reaktywne, przy czym alkiny są zazwyczaj najbardziej reaktywne. Wzory ogólne również odzwierciedlają te różnice: CnH2n+2 dla alkanów, CnH2n dla alkenów i CnH2n-2 dla alkinów.
Zarówno alkeny, jak i alkiny charakteryzują się obecnością wiązania π (pi). Wiązanie to powstaje poprzez boczne nakładanie się orbitali atomowych. Powoduje to wyższą gęstość elektronową między atomami węgla, co zwiększa ich podatność na atak przez odczynniki chemiczne.
Zrozumienie struktury i właściwości alkanów, alkenów i alkinów jest kluczowe. To podstawa do dalszej nauki chemii organicznej. To pozwala na poznanie bardziej skomplikowanych związków i reakcji. Pamiętaj o nazewnictwie i wzorach ogólnych. Ćwicz rozwiązywanie zadań. Powodzenia!