Wodorotlenki to związki chemiczne, które w swojej strukturze zawierają grupę hydroksylową (OH-) związaną z atomem metalu lub z grupą amonową (NH4+). Te związki są bardzo ważne w chemii, ponieważ mają wiele zastosowań w przemyśle i laboratoriach. Przyjrzyjmy się, jak możemy je otrzymać.
Reakcja Metali z Wodą
Jedną z podstawowych metod otrzymywania wodorotlenków jest reakcja aktywnych metali z wodą. Metale alkaliczne (np. lit, sód, potas) i niektóre metale ziem alkalicznych (np. wapń, stront, bar) reagują z wodą, tworząc wodorotlenki i wydzielając wodór. Reakcja ta zachodzi łatwo w temperaturze pokojowej.
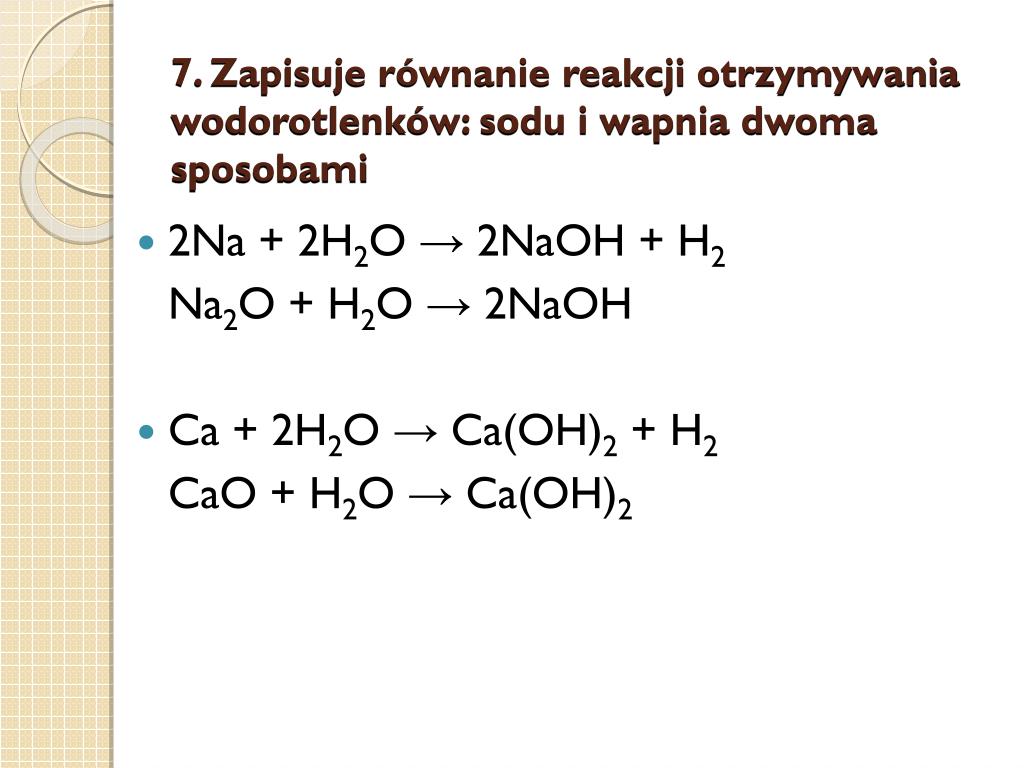
Na przykład, reakcja sodu z wodą przebiega bardzo gwałtownie. Równanie reakcji wygląda następująco: 2Na + 2H2O → 2NaOH + H2↑. Powstaje wodorotlenek sodu (NaOH), który jest silną zasadą, a także wydziela się wodór, który może się zapalić. Warto pamiętać, że reakcję należy przeprowadzać ostrożnie, używając niewielkich ilości metalu i odpowiedniej ochrony.
Reakcja wapnia z wodą jest mniej gwałtowna niż reakcja sodu. Powstaje wodorotlenek wapnia (Ca(OH)2), znany również jako wapno gaszone: Ca + 2H2O → Ca(OH)2 + H2↑. Wodorotlenek wapnia jest stosowany w budownictwie, rolnictwie i przemyśle spożywczym.
Reakcja Tlenków Metali z Wodą
Inną metodą jest reakcja tlenków metali z wodą. Tlenki metali alkalicznych i ziem alkalicznych reagują z wodą, tworząc odpowiednie wodorotlenki. Ta metoda jest szczególnie użyteczna dla metali, które reagują z wodą mniej gwałtownie lub wcale.
Na przykład, reakcja tlenku sodu z wodą prowadzi do powstania wodorotlenku sodu: Na2O + H2O → 2NaOH. Podobnie, reakcja tlenku wapnia z wodą daje wodorotlenek wapnia: CaO + H2O → Ca(OH)2. Tlenek wapnia, zwany wapnem palonym, jest produktem wypalania wapieni.
Warto zauważyć, że nie wszystkie tlenki metali reagują z wodą. Na przykład, tlenki metali przejściowych często są nierozpuszczalne w wodzie i nie tworzą wodorotlenków bezpośrednio w reakcji z wodą. W takim przypadku stosuje się inne metody.
Reakcja Soli z Zasadami
Wodorotlenki metali nierozpuszczalne w wodzie, takie jak wodorotlenek żelaza(III) (Fe(OH)3) lub wodorotlenek miedzi(II) (Cu(OH)2), można otrzymać poprzez reakcję soli danego metalu z rozpuszczalną zasadą (np. wodorotlenkiem sodu lub potasu). W wyniku reakcji powstaje nierozpuszczalny wodorotlenek, który wytrąca się z roztworu.
Na przykład, aby otrzymać wodorotlenek żelaza(III), możemy dodać roztwór wodorotlenku sodu do roztworu chlorku żelaza(III): FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl. Powstający wodorotlenek żelaza(III) jest nierozpuszczalny i tworzy osad. Podobnie, wodorotlenek miedzi(II) powstaje w reakcji soli miedzi(II) z zasadą: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
Ta metoda pozwala na otrzymywanie wodorotlenków metali, które nie reagują bezpośrednio z wodą. Ważne jest, aby użyć odpowiedniej soli i zasady, aby zapewnić wydajną reakcję i czysty produkt.
Elektroliza Roztworów Soli
Kolejną metodą otrzymywania wodorotlenków jest elektroliza roztworów soli. Proces ten polega na przepuszczaniu prądu elektrycznego przez roztwór soli, co powoduje rozkład elektrolityczny i powstawanie różnych produktów, w tym wodorotlenków. Metoda ta jest szczególnie użyteczna do otrzymywania wodorotlenku sodu (NaOH) i chloru (Cl2) z roztworu chlorku sodu (NaCl).
Podczas elektrolizy roztworu chlorku sodu, na katodzie zachodzi redukcja wody, prowadząca do powstania wodorotlenku sodu i wodoru: 2H2O + 2e- → H2↑ + 2OH-. Jony sodu (Na+) migrują do katody, gdzie reagują z jonami wodorotlenkowymi, tworząc wodorotlenek sodu. Na anodzie zachodzi utlenianie jonów chlorkowych, prowadzące do powstania chloru: 2Cl- → Cl2↑ + 2e-.
Elektroliza roztworów soli jest ważną metodą przemysłową, ponieważ pozwala na jednoczesne otrzymywanie kilku cennych produktów, takich jak wodorotlenek sodu, chlor i wodór. Proces ten jest stosowany na dużą skalę w przemyśle chemicznym.
Podsumowanie
Istnieje kilka metod otrzymywania wodorotlenków, w tym reakcja aktywnych metali z wodą, reakcja tlenków metali z wodą, reakcja soli z zasadami oraz elektroliza roztworów soli. Wybór odpowiedniej metody zależy od właściwości danego metalu i pożądanego wodorotlenku. Wszystkie te metody są ważne w chemii i mają liczne zastosowania w przemyśle, laboratoriach i życiu codziennym.