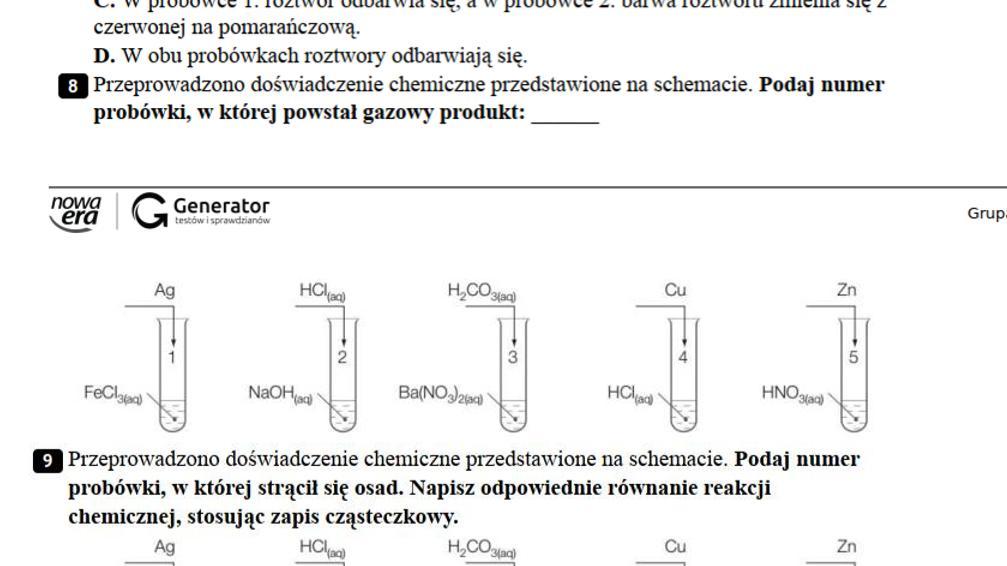
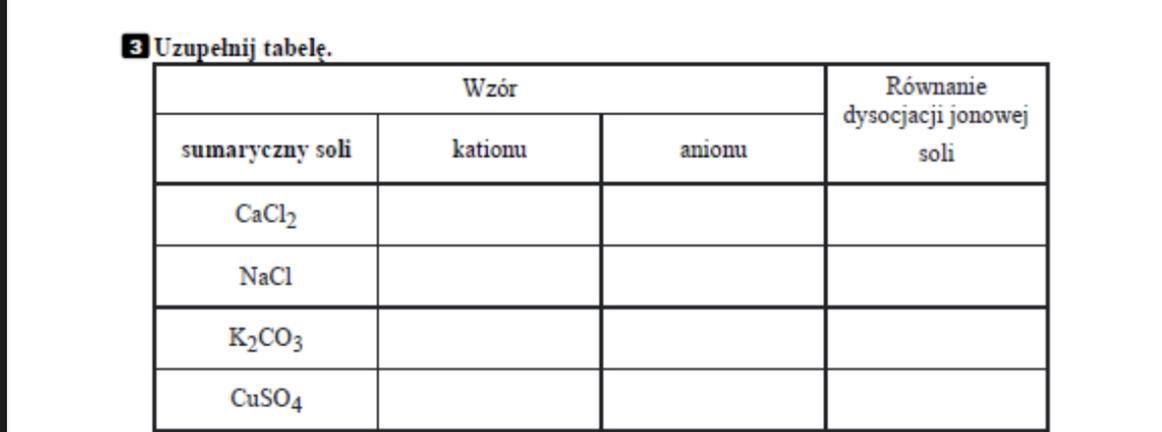
Sole są związkami chemicznymi. Powstają w wyniku reakcji kwasu z zasadą. To ważny temat w ósmej klasie szkoły podstawowej.
Definicja Soli
Sole to związki chemiczne, które powstają, gdy atom wodoru w kwasie zostaje zastąpiony przez atom metalu lub grupę amonową (NH4+). Można również powiedzieć, że sole powstają w reakcji zobojętniania, czyli reakcji kwasu z zasadą. Reakcja ta prowadzi do powstania soli i wody. Na sprawdzianie z chemii w ósmej klasie, definicja soli jest bardzo ważna.
Przykładowo, reakcja kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH) prowadzi do powstania chlorku sodu (NaCl) i wody (H2O). Chlorek sodu, czyli sól kuchenna, jest najbardziej znanym przykładem soli. Ważne jest zrozumienie, jak powstają sole.
Nomenklatura Soli
Nazewnictwo soli opiera się na nazwie metalu i reszty kwasowej. Nazwę soli tworzy się przez połączenie nazwy reszty kwasowej z nazwą metalu w dopełniaczu. Jeśli metal tworzy kilka rodzajów jonów, to po nazwie metalu w nawiasie podaje się jego wartościowość cyframi rzymskimi. To bardzo istotne na sprawdzianie.
Na przykład, chlorek sodu (NaCl) składa się z jonu sodu (Na+) i jonu chlorkowego (Cl-). Siarczan(VI) żelaza(II) (FeSO4) składa się z jonu żelaza(II) (Fe2+) i jonu siarczanowego(VI) (SO42-). Zrozumienie zasad nazewnictwa soli jest kluczowe do rozwiązywania zadań na sprawdzianie z chemii.
Właściwości Soli
Sole to związki jonowe, co oznacza, że składają się z jonów o przeciwnych znakach, połączonych siłami elektrostatycznymi. W temperaturze pokojowej sole są zazwyczaj ciałami stałymi o wysokich temperaturach topnienia i wrzenia. Rozpuszczalność soli w wodzie jest różna. Niektóre sole rozpuszczają się dobrze, inne słabo, a jeszcze inne są praktycznie nierozpuszczalne. To ważne zagadnienie.
Rozpuszczalność soli zależy od wielu czynników, takich jak rodzaj soli, temperatura i obecność innych substancji w roztworze. Sole mogą przewodzić prąd elektryczny, gdy są rozpuszczone w wodzie lub stopione. Dzieje się tak, ponieważ jony mogą swobodnie poruszać się i przenosić ładunek elektryczny. Znajomość tych właściwości jest niezbędna na sprawdzianach.
Otrzymywanie Soli
Istnieje kilka metod otrzymywania soli. Najważniejsze z nich to reakcja kwasu z zasadą (zobojętnianie), reakcja metalu z kwasem, reakcja tlenku metalu z kwasem, reakcja metalu z niemetalem oraz reakcja soli z kwasem lub zasadą. Zrozumienie różnych metod otrzymywania soli pomoże rozwiązać wiele zadań.
Reakcja kwasu z zasadą (zobojętnianie) to najczęściej stosowana metoda. Na przykład, reakcja kwasu siarkowego(VI) (H2SO4) z wodorotlenkiem potasu (KOH) prowadzi do powstania siarczanu(VI) potasu (K2SO4) i wody (H2O). Reakcja metalu z kwasem prowadzi do powstania soli i wodoru. Na przykład, reakcja cynku (Zn) z kwasem solnym (HCl) prowadzi do powstania chlorku cynku (ZnCl2) i wodoru (H2). Pamiętaj o tym na sprawdzianie.
Przykłady Soli i Ich Zastosowania
Chlorek sodu (NaCl), czyli sól kuchenna, jest powszechnie stosowany w kuchni jako przyprawa i konserwant. Węglan sodu (Na2CO3), zwany sodą kalcynowaną, jest używany w przemyśle szklarskim, papierniczym i chemicznym. Siarczan(VI) wapnia (CaSO4), czyli gips, jest stosowany w budownictwie i medycynie.
Azotan(V) potasu (KNO3), czyli saletra potasowa, jest używany jako nawóz sztuczny oraz w produkcji prochu strzelniczego. Węglan wapnia (CaCO3), czyli wapień, jest stosowany w budownictwie, przemyśle cementowym i wapienniczym. Zastosowania soli są szerokie.
Reakcje Charakterystyczne Soli
Sole mogą uczestniczyć w różnych reakcjach chemicznych. Ważne są reakcje strąceniowe, czyli reakcje, w których powstaje nierozpuszczalny osad. Reakcje z kwasami i zasadami również są istotne, prowadzą do wymiany jonów i powstania nowych soli i kwasów lub zasad. Rozpoznawanie reakcji charakterystycznych pomaga na sprawdzianie.
Na przykład, reakcja chlorku baru (BaCl2) z siarczanem(VI) sodu (Na2SO4) prowadzi do powstania osadu siarczanu(VI) baru (BaSO4), który jest nierozpuszczalny w wodzie. Reakcja węglanu wapnia (CaCO3) z kwasem solnym (HCl) prowadzi do powstania chlorku wapnia (CaCl2), wody (H2O) i dwutlenku węgla (CO2). Zrozumienie tych reakcji to klucz do sukcesu na sprawdzianie.
Przygotowanie do Sprawdzianu
Aby dobrze przygotować się do sprawdzianu z soli, warto powtórzyć definicje, nomenklaturę, właściwości i metody otrzymywania soli. Rozwiązywanie zadań z poprzednich sprawdzianów i podręczników jest bardzo pomocne. Zrozumienie reakcji chemicznych, w których uczestniczą sole, jest kluczowe do uzyskania dobrego wyniku. Powodzenia na sprawdzianie!
Pamiętaj o dokładnym czytaniu poleceń i analizowaniu danych. Upewnij się, że dobrze rozumiesz, jak reagują ze sobą różne substancje. Systematyczna nauka i rozwiązywanie zadań to najlepszy sposób na przygotowanie się do sprawdzianu z chemii. To zapewni sukces.
Podsumowując, sole to ważna grupa związków chemicznych, która zasługuje na szczególną uwagę. Ich zrozumienie jest niezbędne na lekcjach chemii w ósmej klasie. Z odpowiednim przygotowaniem, sprawdzian z tego zakresu nie będzie stanowił problemu.