W dzisiejszym artykule przyjrzymy się równaniu dysocjacji jonowej kwasu węglowego. To bardzo ważny proces w chemii, biologii i geologii. Spróbujemy zrozumieć go krok po kroku. Zaczniemy od podstawowych definicji.
Co to jest kwas węglowy?
Kwas węglowy, o wzorze chemicznym H2CO3, jest słabym kwasem nieorganicznym. Powstaje w wyniku rozpuszczenia dwutlenku węgla (CO2) w wodzie (H2O). Proces ten zachodzi naturalnie w atmosferze i w oceanach. Dlatego kwas węglowy odgrywa kluczową rolę w regulacji pH środowiska naturalnego.
Mimo że kwas węglowy jest obecny w roztworach wodnych, jego stężenie jest zazwyczaj niskie. Wynika to z tego, że reakcja rozpuszczania CO2 w wodzie jest odwracalna. Oznacza to, że kwas węglowy łatwo rozkłada się z powrotem na dwutlenek węgla i wodę. Równowaga tej reakcji jest przesunięta w stronę substratów, czyli CO2 i H2O.
Czym jest dysocjacja jonowa?
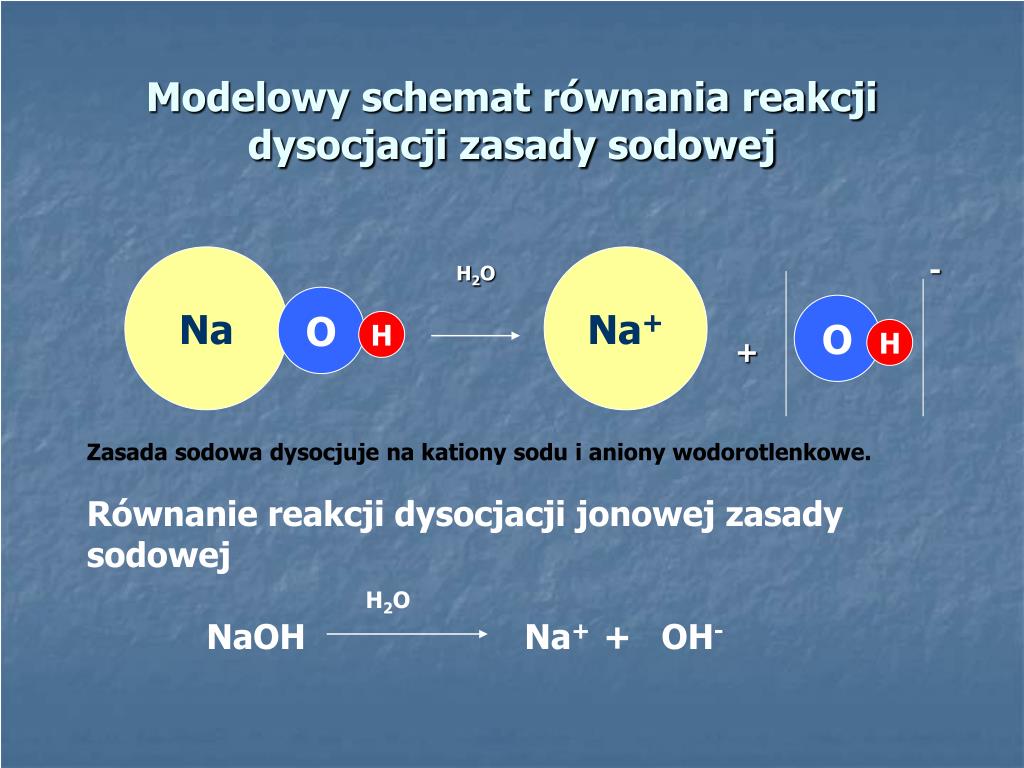
Dysocjacja jonowa to proces, w którym związek chemiczny rozpada się na jony w roztworze wodnym. Jony to atomy lub grupy atomów, które posiadają ładunek elektryczny. Mogą to być jony dodatnie (kationy) lub jony ujemne (aniony).
Dysocjacja jonowa jest charakterystyczna dla elektrolitów. Elektrolity to substancje, które rozpuszczają się w wodzie i przewodzą prąd elektryczny. Dzieje się tak dlatego, że obecność jonów w roztworze umożliwia przepływ ładunku elektrycznego.
Siła dysocjacji jonowej zależy od rodzaju związku chemicznego. Mocne kwasy i zasady ulegają dysocjacji w dużym stopniu. Natomiast słabe kwasy i zasady dysocjują tylko częściowo. Kwas węglowy jest przykładem słabego kwasu.
Równanie dysocjacji jonowej kwasu węglowego
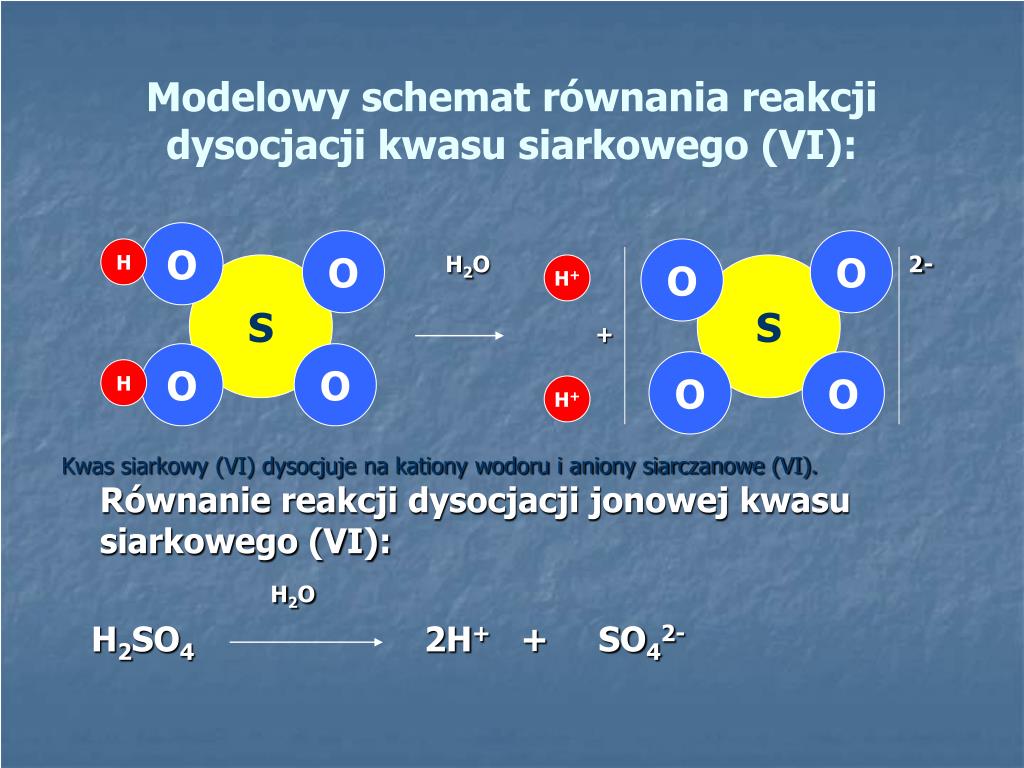
Kwas węglowy ulega dysocjacji jonowej w dwóch etapach. Każdy etap polega na odszczepieniu jednego protonu (jonu wodorowego, H+).
Pierwszy etap dysocjacji:
H2CO3 (aq) ⇌ H+ (aq) + HCO3- (aq)
W tym etapie kwas węglowy (H2CO3) oddaje jeden proton (H+) i przekształca się w jon wodorowęglanowy (HCO3-). Strzałka podwójna (⇌) oznacza, że reakcja jest odwracalna. Oznacza to, że jon wodorowęglanowy może ponownie przyłączyć proton i odtworzyć kwas węglowy.
Drugi etap dysocjacji:
HCO3- (aq) ⇌ H+ (aq) + CO32- (aq)
W tym etapie jon wodorowęglanowy (HCO3-) oddaje kolejny proton (H+) i przekształca się w jon węglanowy (CO32-). Podobnie jak w pierwszym etapie, reakcja jest odwracalna.
Warto zauważyć, że oba etapy dysocjacji kwasu węglowego zachodzą w różnym stopniu. Pierwszy etap dysocjuje w większym stopniu niż drugi. Oznacza to, że w roztworze zawierającym kwas węglowy przeważają cząsteczki H2CO3 i jony HCO3-, a jony CO32- występują w mniejszym stężeniu.
Stała dysocjacji
Siłę kwasu opisuje się za pomocą stałej dysocjacji (Ka). Dla kwasu węglowego mamy dwie stałe dysocjacji, Ka1 i Ka2, odpowiadające dwóm etapom dysocjacji.
Wartość Ka1 dla kwasu węglowego wynosi około 4.3 × 10-7. Wartość Ka2 wynosi około 5.6 × 10-11. Małe wartości Ka potwierdzają, że kwas węglowy jest słabym kwasem.
Wzór na Ka1:
Ka1 = [H+][HCO3-] / [H2CO3]
Wzór na Ka2:
Ka2 = [H+][CO32-] / [HCO3-]
Nawiasy kwadratowe oznaczają stężenie danego związku w roztworze.
Znaczenie kwasu węglowego i jego dysocjacji
Dysocjacja kwasu węglowego ma ogromne znaczenie w wielu dziedzinach.
W biologii: Kwas węglowy i jego jony (HCO3- i CO32-) pełnią ważną rolę w układzie buforowym krwi. Układ ten pomaga utrzymać stałe pH krwi, co jest niezbędne do prawidłowego funkcjonowania organizmu. Zmiany pH krwi mogą prowadzić do poważnych zaburzeń metabolicznych.
W geologii: Kwas węglowy odgrywa istotną rolę w procesach wietrzenia chemicznego skał. Reaguje z minerałami, powodując ich rozpuszczanie i erozję. Ponadto, jony węglanowe (CO32-) są składnikiem skał osadowych, takich jak wapienie i dolomity.
W ochronie środowiska: Dysocjacja kwasu węglowego ma wpływ na zakwaszenie oceanów. Wzrost stężenia dwutlenku węgla w atmosferze powoduje, że więcej CO2 rozpuszcza się w wodzie, co prowadzi do wzrostu stężenia kwasu węglowego i obniżenia pH oceanu. Zakwaszenie oceanów stanowi zagrożenie dla organizmów morskich, zwłaszcza dla tych, które budują swoje szkielety i muszle z węglanu wapnia.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć równanie dysocjacji jonowej kwasu węglowego oraz jego znaczenie w różnych dziedzinach. Zapamiętaj, że jest to słaby kwas, który dysocjuje stopniowo, tworząc jony wodorowęglanowe i węglanowe.