Roztwory to mieszaniny jednorodne, w których co najmniej jedna substancja (substancja rozpuszczona) jest równomiernie rozproszona w innej substancji (rozpuszczalniku). Rozpuszczalnikiem najczęściej jest woda, wtedy mówimy o roztworach wodnych. Ważne jest zrozumienie, że w roztworze nie widać poszczególnych składników gołym okiem.
Składniki roztworu
Każdy roztwór składa się z dwóch podstawowych elementów: rozpuszczalnika i substancji rozpuszczonej. Rozpuszczalnik to substancja, która występuje w większej ilości i w której rozpuszcza się substancja rozpuszczona. Substancja rozpuszczona to ta, która ulega rozproszeniu w rozpuszczalniku. Przykładowo, w roztworze soli kuchennej w wodzie, woda jest rozpuszczalnikiem, a sól jest substancją rozpuszczoną.
Rodzaje roztworów
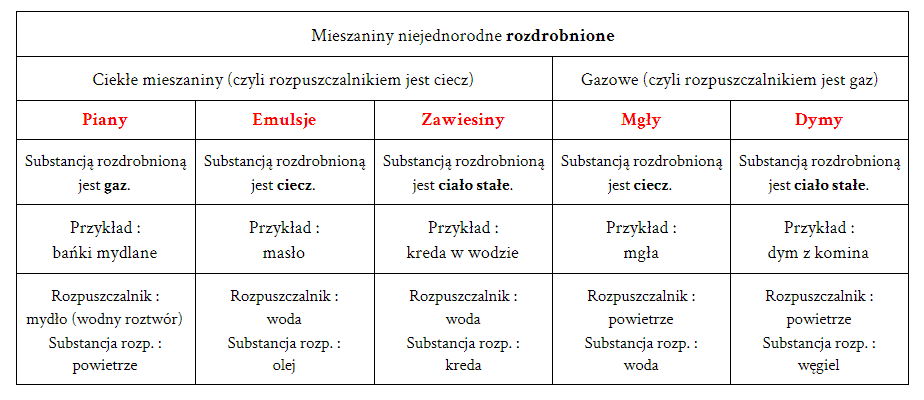
Roztwory możemy klasyfikować na różne sposoby. Ze względu na stan skupienia, rozróżniamy roztwory gazowe (np. powietrze), ciekłe (np. woda z solą) i stałe (np. stopy metali, takie jak brąz). Inny podział uwzględnia wielkość cząstek substancji rozproszonej. W tym przypadku wyróżniamy roztwory właściwe (cząstki substancji rozpuszczonej są bardzo małe), koloidy (cząstki są większe, ale nadal niewidoczne gołym okiem) i zawiesiny (cząstki są na tyle duże, że można je zobaczyć, a roztwór nie jest jednorodny).
Stężenie procentowe roztworu (Cp)
Stężenie procentowe (Cp) to jeden ze sposobów wyrażania składu roztworu. Określa ono, ile gramów substancji rozpuszczonej znajduje się w 100 gramach roztworu. Możemy to obliczyć ze wzoru: Cp = (ms/mr) * 100%, gdzie ms to masa substancji rozpuszczonej, a mr to masa roztworu. Przykładowo, roztwór 10% zawiera 10 gramów substancji rozpuszczonej w 100 gramach roztworu.
Aby obliczyć stężenie procentowe, należy znać masy substancji rozpuszczonej i roztworu. Jeśli znamy masę substancji rozpuszczonej i masę rozpuszczalnika (mw, czyli masa wody), możemy obliczyć masę roztworu, dodając te dwie wartości: mr = ms + mw. Następnie podstawiamy te wartości do wzoru na stężenie procentowe. Pamiętaj, że jednostki masy muszą być takie same (np. gramy).
Przykładowe zadanie: Oblicz stężenie procentowe roztworu, w którym rozpuszczono 20g cukru w 180g wody. Masa substancji rozpuszczonej (cukru) to 20g. Masa rozpuszczalnika (wody) to 180g. Masa roztworu to 20g + 180g = 200g. Stężenie procentowe: Cp = (20g / 200g) * 100% = 10%. Czyli roztwór ma stężenie 10%.
Stężenie molowe roztworu (Cm)
Stężenie molowe (Cm) to kolejny sposób wyrażania składu roztworu. Określa ono liczbę moli substancji rozpuszczonej w 1 dm3 (litrze) roztworu. Obliczamy je ze wzoru: Cm = n/V, gdzie n to liczba moli substancji rozpuszczonej, a V to objętość roztworu w dm3. Jednostką stężenia molowego jest mol/dm3 (M).
Aby obliczyć stężenie molowe, musimy znać liczbę moli substancji rozpuszczonej i objętość roztworu. Jeśli znamy masę substancji rozpuszczonej (ms) i jej masę molową (M), możemy obliczyć liczbę moli: n = ms/M. Masa molowa to masa jednego mola danej substancji, którą odczytujemy z układu okresowego pierwiastków (dla związków chemicznych obliczamy ją sumując masy atomowe wszystkich pierwiastków wchodzących w skład związku). Następnie podstawiamy obliczone wartości do wzoru na stężenie molowe. Pamiętaj, że objętość roztworu musi być wyrażona w dm3 (1 dm3 = 1 litr).
Przykładowe zadanie: Oblicz stężenie molowe roztworu, w którym rozpuszczono 4g NaOH w 200 cm3 wody. Masa molowa NaOH wynosi około 40g/mol. Liczba moli NaOH: n = 4g / 40g/mol = 0,1 mol. Objętość roztworu: 200 cm3 = 0,2 dm3. Stężenie molowe: Cm = 0,1 mol / 0,2 dm3 = 0,5 mol/dm3. Czyli stężenie molowe roztworu wynosi 0,5 M.
Rozpuszczalność
Rozpuszczalność to maksymalna ilość substancji, którą można rozpuścić w danej ilości rozpuszczalnika w danej temperaturze. Zazwyczaj rozpuszczalność podaje się w gramach substancji na 100g rozpuszczalnika (np. w 100g wody). Rozpuszczalność zależy od rodzaju substancji rozpuszczanej i rozpuszczalnika, temperatury oraz, w przypadku gazów, od ciśnienia. Wraz ze wzrostem temperatury, rozpuszczalność ciał stałych zwykle rośnie, a gazów maleje.
Roztwory dzielimy na nienasycone, nasycone i przesycone. Roztwór nienasycony to taki, w którym można jeszcze rozpuścić więcej substancji. Roztwór nasycony to taki, w którym rozpuściła się maksymalna ilość substancji w danej temperaturze. Roztwór przesycony to taki, w którym znajduje się więcej substancji rozpuszczonej niż wynika to z rozpuszczalności w danej temperaturze. Roztwory przesycone są nietrwałe i łatwo dochodzi w nich do wytrącania się nadmiaru substancji w postaci osadu.
Zastosowania roztworów
Roztwory znajdują szerokie zastosowanie w różnych dziedzinach życia. W przemyśle chemicznym używane są jako reagenty, rozpuszczalniki i środki czyszczące. W medycynie stosuje się je do przygotowywania leków i roztworów infuzyjnych. W życiu codziennym roztwory są obecne w produktach spożywczych (np. napoje, ocet), kosmetykach (np. płyny do demakijażu) i środkach czystości (np. płyny do mycia naczyń).
Roztwory odgrywają kluczową rolę w wielu procesach biologicznych. Krew jest przykładem złożonego roztworu, który transportuje tlen, składniki odżywcze i hormony do wszystkich komórek organizmu. Soki trawienne zawierają enzymy, które rozpuszczają i trawią pokarm. Procesy te umożliwiają funkcjonowanie organizmów żywych.