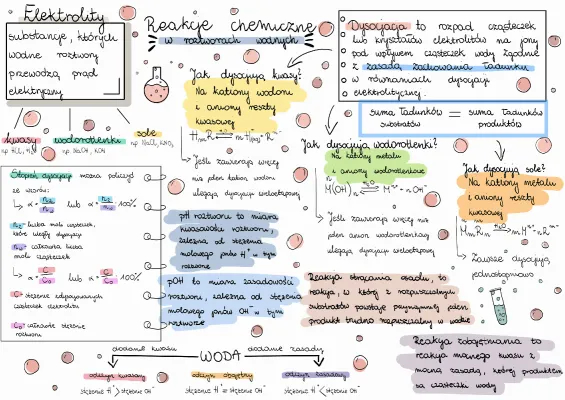
Witaj! Przygotowujesz się do sprawdzianu z reakcji chemicznych w roztworach wodnych? Świetnie! Rozłóżmy to zagadnienie na czynniki pierwsze. Grupa B? Nie martw się, to tylko nazwa. Skupmy się na zrozumieniu.
Czym są roztwory wodne?
Zacznijmy od podstaw. Roztwór wodny to mieszanina, w której rozpuszczalnikiem jest woda. Myśl o herbacie. Woda to rozpuszczalnik, a herbata (a raczej substancje z niej) to substancja rozpuszczona.
Co to znaczy, że coś się rozpuszcza? To znaczy, że cząsteczki substancji rozpadają się i mieszają z cząsteczkami wody. Sól w wodzie? Cukier w herbacie? To są roztwory wodne!
Reakcje chemiczne w roztworach wodnych
Reakcja chemiczna to proces, w którym substancje (reagenty) przekształcają się w inne substancje (produkty). Dzieje się to poprzez zrywanie i tworzenie wiązań chemicznych.
W roztworach wodnych, te reakcje zachodzą w środowisku wodnym. Woda wpływa na to, jak reagenty się poruszają i jak się ze sobą oddziałują.
Weźmy przykład. Wyobraź sobie mieszanie dwóch różnych roztworów. Może powstać coś zupełnie nowego!
Rodzaje reakcji w roztworach wodnych
Reakcje strąceniowe
To reakcje, w których powstaje osad. Osad to ciało stałe, które wytrąca się z roztworu. Widziałeś kiedyś, jak woda w czajniku robi się biała po zagotowaniu? To osad! (Choć tam proces jest trochę inny, idea podobna).
Jak przewidzieć, czy osad powstanie? Używamy tabeli rozpuszczalności. Mówi nam ona, które związki są dobrze rozpuszczalne w wodzie, a które nie. Jeśli produkt reakcji jest nierozpuszczalny, to powstanie osad.
Na przykład: Azotan ołowiu (II) (Pb(NO3)2) reaguje z jodkiem potasu (KI). Powstaje jodek ołowiu (II) (PbI2), który jest żółtym osadem, oraz azotan potasu (KNO3).
Równanie reakcji: Pb(NO3)2(aq) + 2KI(aq) → PbI2(s) + 2KNO3(aq)
Zauważ (aq) oznacza roztwór wodny, a (s) – ciało stałe (osad).
Reakcje kwasowo-zasadowe (reakcje zobojętniania)
Kwasy i zasady reagują ze sobą w procesie zwanym zobojętnianiem. Kwas i zasada "zwalczają się" wzajemnie, tworząc sól i wodę.
Co to jest kwas? Substancja, która oddaje jony wodorowe (H+). Ma kwaśny smak (ale nie próbuj!). Co to jest zasada? Substancja, która przyjmuje jony wodorowe (H+). Ma gorzki smak i jest śliska w dotyku (ale też nie próbuj!).
Skala pH mierzy kwasowość lub zasadowość roztworu. pH 7 to odczyn obojętny. pH poniżej 7 to odczyn kwaśny. pH powyżej 7 to odczyn zasadowy.
Przykład: Kwas solny (HCl) reaguje z wodorotlenkiem sodu (NaOH). Powstaje chlorek sodu (NaCl, czyli sól kuchenna) i woda (H2O).
Równanie reakcji: HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Reakcje redoks (utleniania-redukcji)
Reakcje redoks to reakcje, w których następuje wymiana elektronów. Jedna substancja traci elektrony (utlenianie), a druga zyskuje elektrony (redukcja). Zawsze zachodzą parami: jeśli coś się utlenia, to coś innego musi się zredukować.
Pomyśl o rdzy. Żelazo (Fe) utlenia się, reagując z tlenem (O2) z powietrza. Tlen się redukuje.
Jak rozpoznać reakcję redoks? Zwróć uwagę na stopnie utlenienia atomów. Jeśli stopień utlenienia się zmienia, to mamy do czynienia z reakcją redoks.
Przykład: Cynk (Zn) reaguje z roztworem siarczanu miedzi (II) (CuSO4). Cynk się utlenia, przechodząc do roztworu jako jony cynku (Zn2+), a jony miedzi (Cu2+) redukują się do metalicznej miedzi (Cu), która osadza się na cynku.
Równanie reakcji: Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Równania jonowe i jonowe skrócone
W roztworach wodnych, związki jonowe (np. sól kuchenna) rozpadają się na jony. Równanie jonowe pokazuje wszystkie jony obecne w roztworze.
Równanie jonowe skrócone pokazuje tylko jony, które rzeczywiście biorą udział w reakcji. Jony, które się nie zmieniają (jony widzowe), są pomijane.
Weźmy przykład reakcji strąceniowej: Azotan ołowiu (II) reaguje z jodkiem potasu.
Równanie cząsteczkowe: Pb(NO3)2(aq) + 2KI(aq) → PbI2(s) + 2KNO3(aq)
Równanie jonowe: Pb2+(aq) + 2NO3-(aq) + 2K+(aq) + 2I-(aq) → PbI2(s) + 2K+(aq) + 2NO3-(aq)
Równanie jonowe skrócone: Pb2+(aq) + 2I-(aq) → PbI2(s)
Zauważ, że jony azotanowe (NO3-) i jony potasu (K+) są jonami widzowymi – nie biorą udziału w tworzeniu osadu.
Stechiometria reakcji w roztworach wodnych
Stechiometria to dział chemii, który zajmuje się ilościowymi zależnościami między reagentami i produktami w reakcjach chemicznych.
W roztworach wodnych często używamy stężenia molowego (mol/L) do określenia ilości substancji w roztworze.
Aby obliczyć, ile produktu powstanie z danej ilości reagentów, musimy znać równanie reakcji i stężenia reagentów. Używamy współczynników stechiometrycznych z równania reakcji, aby przeliczyć mole reagentów na mole produktów.
Podsumowanie
Reakcje chemiczne w roztworach wodnych są wszędzie! Od gotowania po procesy przemysłowe. Kluczem do sukcesu jest zrozumienie podstawowych pojęć: roztwory, reakcje, kwasy, zasady, redoks, osady. Ćwicz rozwiązywanie zadań, a sprawdzian Grupy B nie będzie straszny!
Pamiętaj: Rozłóż problem na mniejsze części, zdefiniuj kluczowe terminy i szukaj przykładów z życia codziennego. Powodzenia!