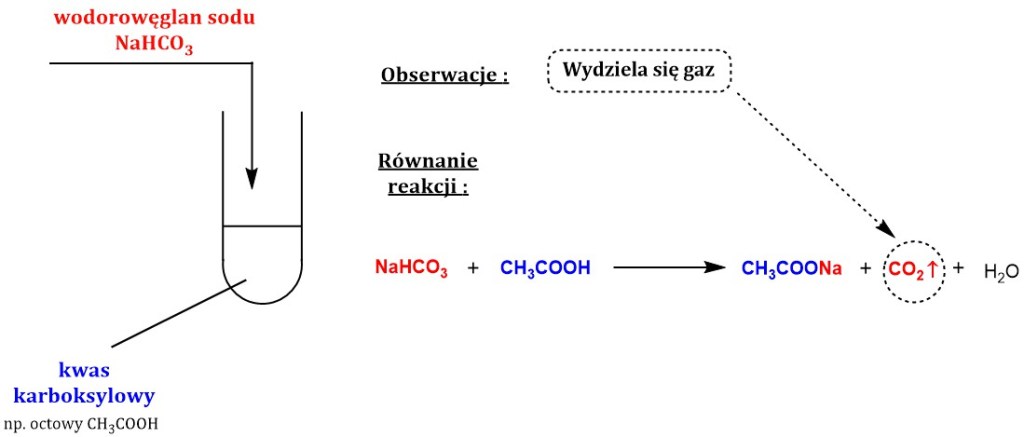
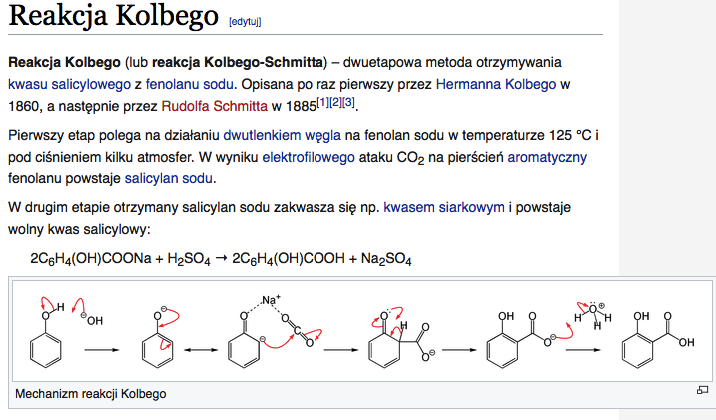Chemia może wydawać się skomplikowana, ale wiele reakcji chemicznych jest obecnych w naszym życiu codziennym. Zajmiemy się reakcją kwasu mrówkowego z wapniem. Rozłożymy ją na mniejsze części, aby zrozumieć, co się dzieje.
Podstawy: Co to jest Kwas i Zasada?
Zacznijmy od podstaw. Kwas to substancja, która oddaje jony wodorowe (H+). Mają one kwaśny smak. Przykładem z życia codziennego jest sok z cytryny.
Zasada, odwrotnie, przyjmuje jony wodorowe. Często zasady mają gorzki smak i są śliskie w dotyku. Mydło jest dobrym przykładem zasady.
Skala pH mierzy kwasowość lub zasadowość roztworu. Wartości pH od 0 do 6 oznaczają substancje kwasowe. pH 7 jest neutralne. Wartości od 8 do 14 oznaczają substancje zasadowe. Zrozumienie tego jest kluczowe do dalszej analizy.
Kwas Mrówkowy: Krótka Charakterystyka
Kwas mrówkowy (kwas metanowy), ma wzór chemiczny HCOOH. Jest to najprostszy kwas karboksylowy. Występuje naturalnie w jadzie mrówek (stąd nazwa), pokrzywach i igłach sosnowych.
Kwas mrówkowy jest bezbarwną cieczą o ostrym, drażniącym zapachu. Jest słabszy od innych popularnych kwasów, takich jak kwas solny (HCl) czy kwas siarkowy (H2SO4), ale nadal wykazuje właściwości kwasowe. W przemyśle wykorzystuje się go w garbarstwie, do konserwacji pasz, a także w syntezie chemicznej.
Czy kiedykolwiek ukąsiła Cię mrówka? To właśnie kwas mrówkowy powoduje to pieczenie. To daje wyobrażenie o jego działaniu.
Wapń: Pierwiastek Chemiczny
Wapń (Calcium), o symbolu chemicznym Ca, jest pierwiastkiem z grupy metali ziem alkalicznych. Jest bardzo powszechny w przyrodzie. Znajduje się w skałach, glebie, a także w organizmach żywych.
Wapń jest niezbędny dla prawidłowego funkcjonowania organizmu człowieka. Buduje kości i zęby. Uczestniczy w procesach krzepnięcia krwi i skurczu mięśni. Źródłem wapnia w diecie są produkty mleczne, zielone warzywa liściaste i orzechy.
Pomyśl o skorupkach jajek – one też zawierają dużo wapnia! Wapń jest ważnym składnikiem budulcowym.
Reakcja Kwasu Mrówkowego z Wapniem: Co się Dzieje?
Gdy kwas mrówkowy reaguje z wapniem, zachodzi reakcja neutralizacji. Kwas reaguje z metalem, tworząc mrówczan wapnia i wodór.
Równanie reakcji wygląda następująco:
2 HCOOH + Ca → Ca(HCOO)2 + H2
Oznacza to, że dwie cząsteczki kwasu mrówkowego reagują z jednym atomem wapnia. Powstaje jedna cząsteczka mrówczanu wapnia i jedna cząsteczka wodoru.
Mrówczan wapnia (Calcium formate) jest solą kwasu mrówkowego. Jest to białe ciało stałe, dobrze rozpuszczalne w wodzie. Znajduje zastosowanie jako dodatek do pasz dla zwierząt oraz jako przyspieszacz wiązania cementu.
Wodór (H2) jest gazem bezbarwnym i bezwonnym. Jest bardzo łatwopalny. W tej reakcji wodór uwalnia się w postaci gazu. Podczas eksperymentu należy zachować ostrożność, ponieważ wodór jest palny.
Szczegółowy Przebieg Reakcji
Proces ten rozpoczyna się, gdy kwas mrówkowy wchodzi w kontakt z wapniem. Kwas mrówkowy oddaje jony wodorowe (H+). Wapń, jako metal, oddaje dwa elektrony (Ca2+).
Jony wapnia (Ca2+) łączą się z jonami mrówczanowymi (HCOO-) tworząc mrówczan wapnia (Ca(HCOO)2). Elektrony oddane przez wapń są przechwytywane przez jony wodorowe (H+) z kwasu mrówkowego. Powstaje wodór (H2), który uwalnia się w postaci gazu.
Ta reakcja jest przykładem reakcji redoks (utleniania-redukcji). Wapń ulega utlenieniu (oddaje elektrony), a jony wodorowe ulegają redukcji (przyjmują elektrony).
Obserwacje Podczas Reakcji
Podczas przeprowadzania reakcji kwasu mrówkowego z wapniem można zaobserwować kilka zjawisk. Przede wszystkim, obserwuje się wydzielanie się gazu. Jest to wodór, który powstaje w wyniku reakcji.
Można również zauważyć rozpuszczanie się wapnia. Metal stopniowo zanika, reagując z kwasem mrówkowym. Roztwór staje się cieplejszy. Reakcja ta jest egzotermiczna, co oznacza, że wydziela ciepło.
Jeśli reakcja zachodzi w otwartym naczyniu, można usłyszeć charakterystyczny szum lub syk, spowodowany uwalnianiem się gazowego wodoru.
Zastosowania i Znaczenie Reakcji
Reakcja kwasu mrówkowego z wapniem nie ma bezpośrednich zastosowań w życiu codziennym. Ale zrozumienie tego typu reakcji jest ważne w kontekście chemii i jej zastosowań przemysłowych.
Na przykład, reakcje metali z kwasami są wykorzystywane w procesach produkcyjnych i w laboratoriach do otrzymywania różnych substancji chemicznych. Znajomość mechanizmów takich reakcji pozwala na optymalizację procesów przemysłowych i opracowywanie nowych technologii.
Dodatkowo, reakcje neutralizacji, w których uczestniczą kwasy i zasady (lub metale, które zachowują się jak zasady), są kluczowe w wielu procesach biologicznych i chemicznych. Utrzymywanie odpowiedniego pH w organizmach żywych jest niezbędne do prawidłowego funkcjonowania enzymów i innych białek.
Podsumowując, reakcja kwasu mrówkowego z wapniem jest dobrym przykładem reakcji chemicznej, która ilustruje podstawowe zasady chemii. Zrozumienie tej reakcji pozwala lepiej zrozumieć inne, bardziej złożone procesy chemiczne. Pamiętaj o bezpieczeństwie podczas przeprowadzania eksperymentów chemicznych!