Hej! Gotowi na powtórkę z estryfikacji? Super! Ten artykuł pomoże Ci zrozumieć wszystko, co najważniejsze. Zaczynamy!
Czym jest Estryfikacja?
Estryfikacja to reakcja chemiczna. W jej wyniku powstaje ester i woda. Reagują ze sobą kwas karboksylowy i alkohol.
Zapamiętaj: Kwas + Alkohol → Ester + Woda.
Reakcja ogólna
Ogólny wzór reakcji estryfikacji wygląda następująco:
RCOOH + R'OH ⇌ RCOOR' + H2O
Gdzie:
- RCOOH to kwas karboksylowy.
- R'OH to alkohol.
- RCOOR' to ester.
- H2O to woda.
Symbol ⇌ oznacza, że reakcja jest odwracalna. Oznacza to, że może przebiegać w obie strony.
Mechanizm Estryfikacji
Mechanizm jest trochę bardziej skomplikowany, ale postaram się go uprościć. Reakcja zwykle wymaga katalizatora. Najczęściej jest to kwas siarkowy(VI) (H2SO4).
Kwas siarkowy protonuje tlen z grupy karbonylowej kwasu karboksylowego. To zwiększa elektrofilowość węgla karbonylowego. Alkohol atakuje węgiel karbonylowy. Następuje szereg przegrupowań protonów i eliminacja wody. W efekcie otrzymujemy ester.
Rola Katalizatora
Katalizator, czyli np. kwas siarkowy, przyspiesza reakcję. Sam nie zużywa się w procesie. Pozwala na szybsze osiągnięcie stanu równowagi.
Przykłady Estryfikacji
Zobaczmy teraz kilka konkretnych przykładów, żeby lepiej to wszystko zrozumieć.
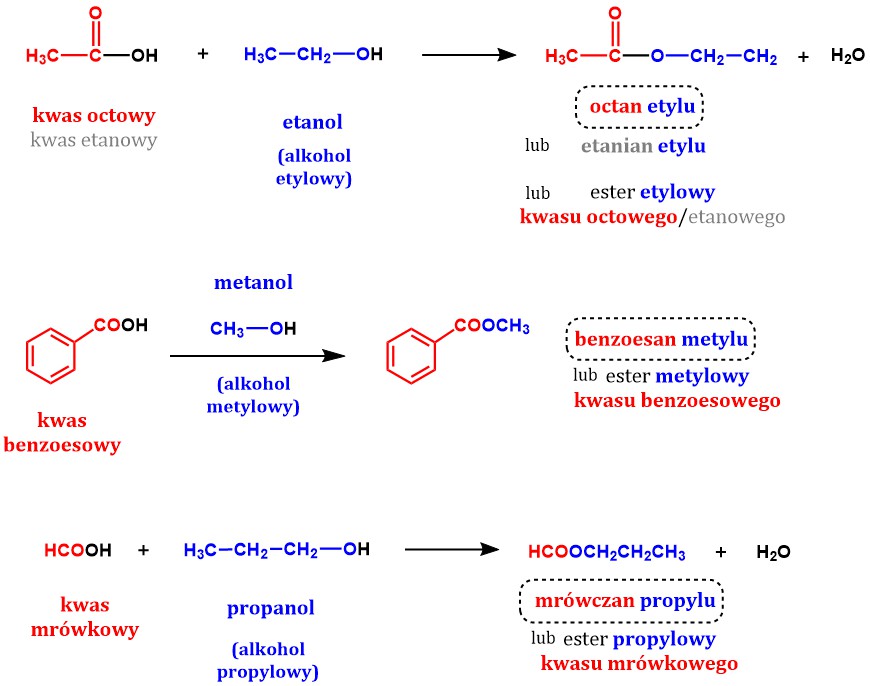
Estryfikacja Kwasu Octowego
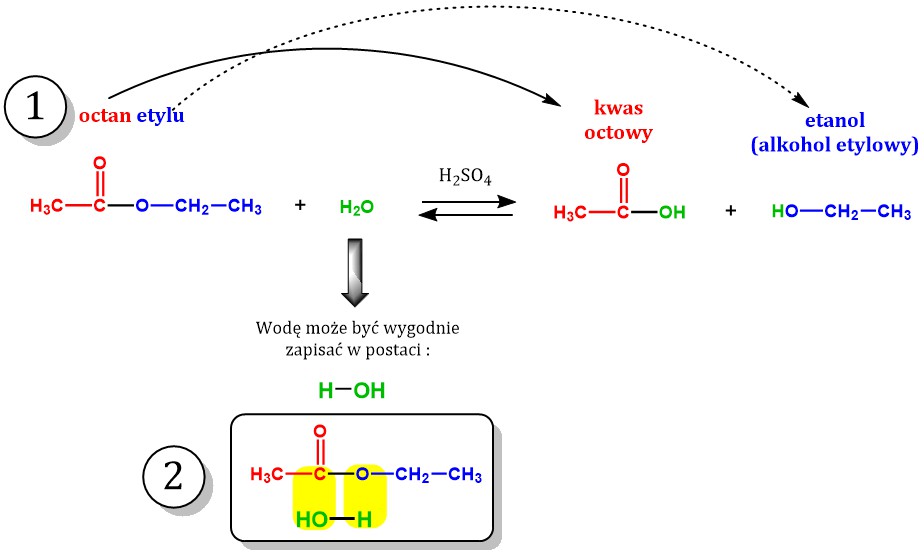
Kwas octowy (CH3COOH) reaguje z etanolem (C2H5OH). Powstaje octan etylu (CH3COOC2H5) i woda.
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
Octan etylu ma przyjemny, owocowy zapach. Jest stosowany jako rozpuszczalnik.
Estryfikacja Kwasu Masłowego
Kwas masłowy (C3H7COOH) reaguje z metanolem (CH3OH). Powstaje maślan metylu (C3H7COOCH3) i woda.
C3H7COOH + CH3OH ⇌ C3H7COOCH3 + H2O
Maślan metylu również ma przyjemny zapach. Można go znaleźć w niektórych owocach.
Estryfikacja Kwasu Salicylowego
Kwas salicylowy reaguje z bezwodnikiem octowym. Powstaje kwas acetylosalicylowy (aspiryna) i kwas octowy.
C7H6O3 + (CH3CO)2O → C9H8O4 + CH3COOH
To ważny przykład w farmacji. Aspiryna to popularny lek przeciwbólowy i przeciwzapalny.
Właściwości Estrów
Estry charakteryzują się różnymi właściwościami. Zależą one od budowy cząsteczki. Generalnie mają przyjemne zapachy. Są słabo rozpuszczalne w wodzie. Dobrze rozpuszczają się w rozpuszczalnikach organicznych.
Mają niższe temperatury wrzenia niż odpowiadające im alkohole i kwasy karboksylowe. Jest to spowodowane brakiem wiązań wodorowych między cząsteczkami estru.
Zastosowanie Estrów
Estry mają szerokie zastosowanie. Są używane w:
- Przemyśle spożywczym (jako aromaty).
- Przemyśle kosmetycznym (w perfumach).
- Przemyśle farmaceutycznym (w lekach).
- Jako rozpuszczalniki.
- Do produkcji tworzyw sztucznych.
Czynniki wpływające na reakcję estryfikacji
Na przebieg reakcji estryfikacji wpływa kilka czynników:
- Stężenie substratów: Wyższe stężenia kwasu i alkoholu przyspieszają reakcję.
- Katalizator: Obecność katalizatora przyspiesza reakcję.
- Temperatura: Wyższa temperatura zazwyczaj przyspiesza reakcję, ale zbyt wysoka może prowadzić do niepożądanych reakcji ubocznych.
- Usuwanie wody: Usuwanie wody z mieszaniny reakcyjnej przesuwa równowagę w prawo, zwiększając wydajność estru.
Podsumowanie
No i to by było na tyle! Pamiętaj, estryfikacja to reakcja kwasu karboksylowego z alkoholem, w wyniku której powstaje ester i woda. Reakcja jest odwracalna i często katalizowana kwasem. Estry mają szerokie zastosowanie, zwłaszcza ze względu na swoje przyjemne zapachy. Powodzenia na egzaminie!