Hej! Gotowi na powtórkę z chemii? Dzisiaj rozłożymy na czynniki pierwsze doświadczenie, w którym do roztworu zasady dodawano coś ciekawego.
Wprowadzenie do zagadnienia
Zacznijmy od podstaw. Co to jest roztwór zasady?
To roztwór wodny, który zawiera jony hydroksylowe (OH-). Zasady mają pH powyżej 7. Najpopularniejsze zasady to wodorotlenek sodu (NaOH) i wodorotlenek potasu (KOH).
Pamiętajmy, że doświadczenie chemiczne to proces, w którym obserwujemy zmiany zachodzące w substancjach.
Celem jest zazwyczaj zbadanie reakcji chemicznej.
Możliwe scenariusze doświadczenia
Do roztworu zasady można dodać wiele różnych substancji. Spójrzmy na kilka prawdopodobnych scenariuszy.
Dodawanie kwasu
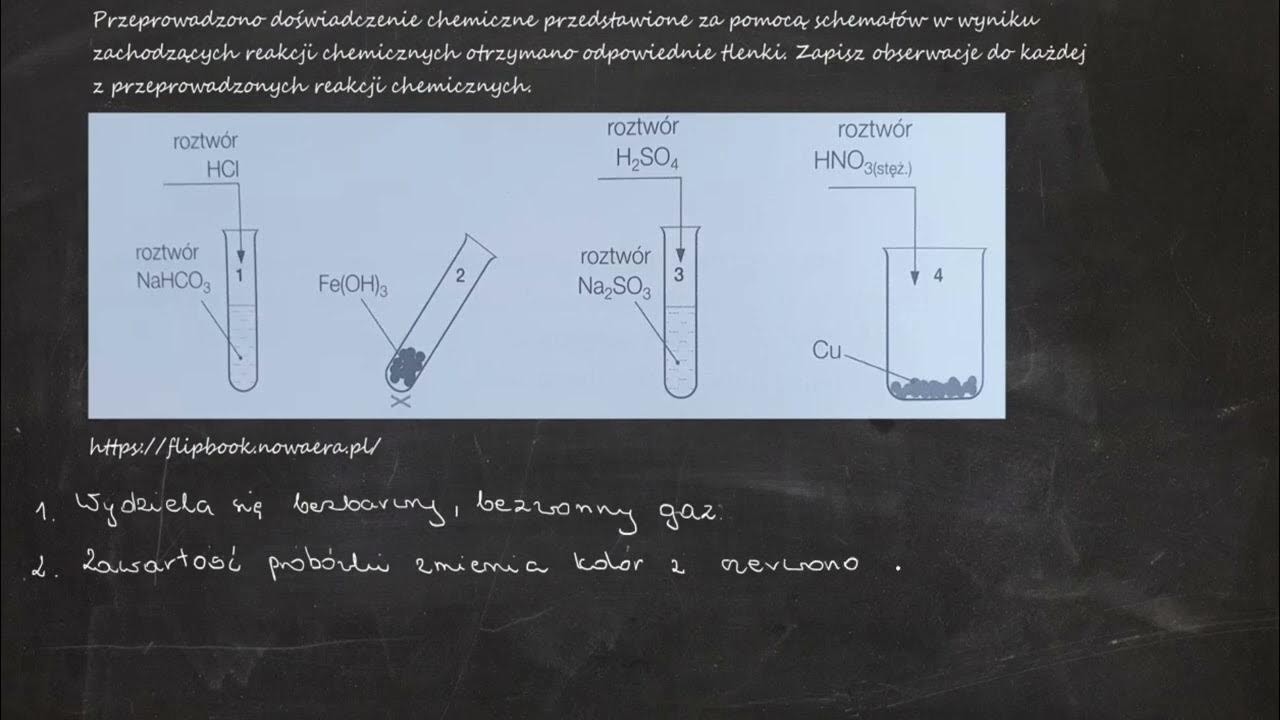
Najbardziej klasyczna reakcja! Kwas reaguje z zasadą w procesie neutralizacji.
Reakcja neutralizacji to reakcja, w której kwas i zasada reagują ze sobą, tworząc sól i wodę.
Na przykład: HCl + NaOH → NaCl + H2O. HCl to kwas solny, a NaOH to wodorotlenek sodu.
Obserwacje: Spadek pH roztworu. Jeśli dodamy wskaźnik (np. fenoloftaleinę), zobaczymy zmianę koloru.
Dodawanie soli
Dodanie soli może prowadzić do różnych efektów, w zależności od samej soli. Może dojść do wytrącenia się osadu.
Osad to nierozpuszczalna substancja, która wytrąca się z roztworu.
Przykład: Dodanie chlorku żelaza (III) (FeCl3) do wodorotlenku sodu (NaOH) spowoduje powstanie osadu wodorotlenku żelaza (III) (Fe(OH)3): FeCl3 + 3NaOH → Fe(OH)3(↓) + 3NaCl.
Obserwacje: Pojawienie się osadu, zmiana koloru roztworu.
Dodawanie metalu
Niektóre metale mogą reagować z zasadami, szczególnie z mocnymi zasadami, takimi jak wodorotlenek sodu. Reakcja ta często prowadzi do wydzielania się wodoru.
Przykład: Reakcja glinu (Al) z wodorotlenkiem sodu (NaOH): 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2(↑). W tym przypadku powstaje tetrahydroksoglinian sodu i wodór.
Obserwacje: Wydzielanie się gazu (wodoru), wzrost temperatury roztworu.
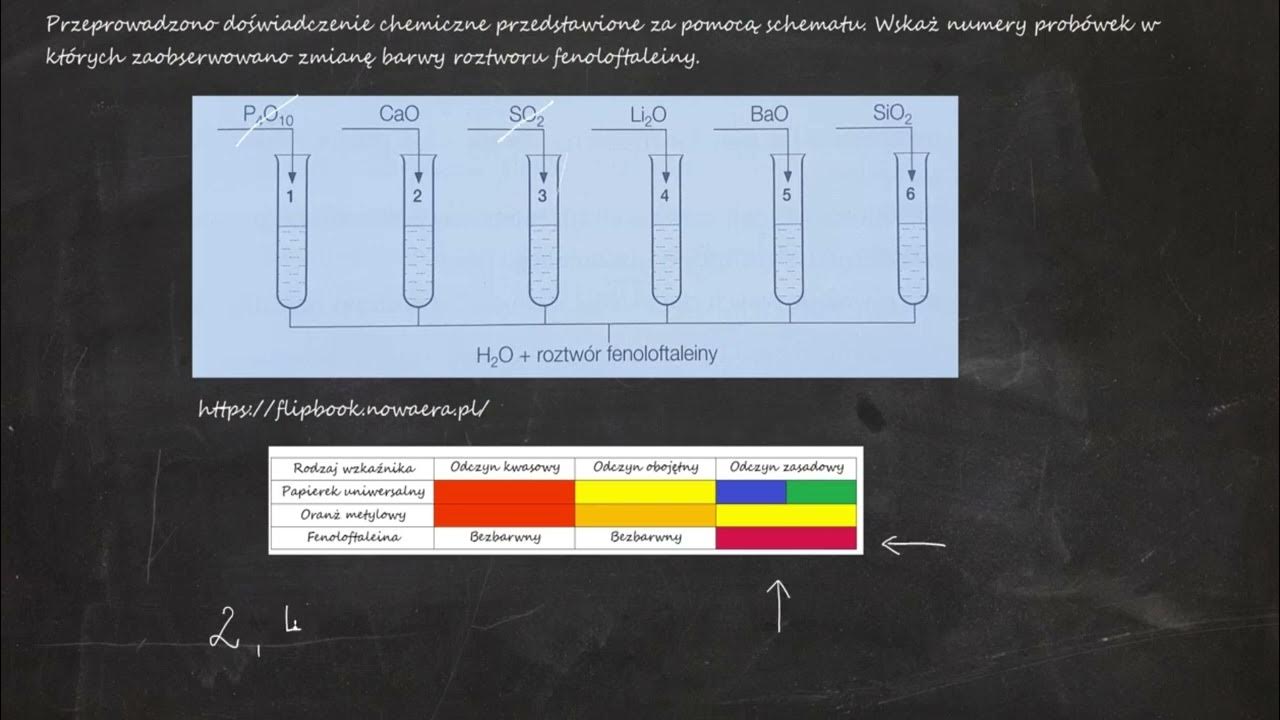
Dodawanie wskaźnika
Wskaźniki to substancje, które zmieniają kolor w zależności od pH roztworu. Pomagają nam zidentyfikować, czy roztwór jest kwasowy, zasadowy czy obojętny.
Przykłady: Fenoloftaleina (bezbarwna w kwasach, różowa w zasadach), lakmus (czerwony w kwasach, niebieski w zasadach).
Obserwacje: Zmiana koloru roztworu.
Analiza wyników doświadczenia
Bardzo ważne jest, aby dokładnie zanotować wszystkie obserwacje podczas doświadczenia. Zwróć uwagę na:
- Zmiany koloru roztworu
- Powstawanie osadu
- Wydzielanie się gazu
- Zmiany temperatury
- Zmiany pH
Na podstawie tych obserwacji możemy wywnioskować, jaka reakcja chemiczna zaszła.
Następnie, musimy napisać równanie reakcji, uwzględniając wszystkie reagenty i produkty.
Pamiętaj o bilansowaniu równania, czyli upewnieniu się, że po obu stronach równania jest taka sama liczba atomów każdego pierwiastka.
Przykładowe zadanie
Załóżmy, że do roztworu wodorotlenku potasu (KOH) dodano kwas siarkowy (H2SO4). Zaobserwowano spadek pH roztworu.
Analiza: Doszło do reakcji neutralizacji. Kwas siarkowy zareagował z wodorotlenkiem potasu, tworząc siarczan potasu i wodę.
Równanie reakcji: H2SO4 + 2KOH → K2SO4 + 2H2O.
Podsumowanie
Podsumowując, kluczowe aspekty to:
- Zrozumienie, czym jest roztwór zasady i jakie ma właściwości.
- Znajomość różnych typów reakcji, które mogą zajść po dodaniu różnych substancji do zasady (np. neutralizacja, tworzenie osadu, wydzielanie gazu).
- Umiejętność obserwacji i analizy wyników doświadczenia (zmiany koloru, powstawanie osadu, wydzielanie gazu, zmiany pH).
- Zapisywanie i bilansowanie równań reakcji chemicznych.
Pamiętaj! Najważniejsze to zrozumieć mechanizm reakcji, a reszta pójdzie gładko. Powodzenia na egzaminie!