Cześć! Zajmiemy się dzisiaj dysocjacją jonową soli. Przygotuj się na wizualną podróż po świecie cząsteczek!
Wyobraź sobie sól kuchenną, NaCl. To nasz główny bohater.
Czym w ogóle jest dysocjacja jonowa? To proces rozpadu związku chemicznego na jony pod wpływem rozpuszczalnika, np. wody.
Pomyśl o soli jako o parze zakochanych - Na+ (sodzie) i Cl- (chlorze). Mocno się trzymają za ręce, tworząc kryształ soli.
Woda wkracza do akcji!
Teraz do akcji wchodzi woda (H2O). Wyobraź sobie cząsteczki wody jako małe, przyjazne potwory z wystającymi "rękami".
Te "ręce" to bieguny cząsteczki wody. Tlen (O) jest bardziej elektroujemny i ma ładunek częściowo ujemny (δ-), a wodór (H) ma ładunek częściowo dodatni (δ+).
Cząsteczki wody otaczają kryształ soli. Ich ujemne "ręce" (tlen) zbliżają się do dodatnio naładowanego sodu (Na+). A ich dodatnie "ręce" (wodór) zbliżają się do ujemnie naładowanego chloru (Cl-).
To jak silne magnesy próbujące rozdzielić parę.
Hydratacja – otaczanie jonów przez wodę
Proces otaczania jonów przez cząsteczki wody nazywamy hydratacją. Jony sodu (Na+) i chloru (Cl-) są dosłownie oblężone przez cząsteczki wody.
Wyobraź sobie, że każdy jon jest otoczony kokonem z cząsteczek wody. Ten kokon osłabia siłę przyciągania między jonami sodu i chloru.
Siły przyciągania między jonami sodu i chloru w krysztale soli słabną, ponieważ każda z nich jest otoczona przez cząsteczki wody.
W końcu, siła "kokonu" wody jest wystarczająco duża, aby zerwać "uścisk dłoni" między sodem i chlorem.
Kryształ soli rozpada się!
Powstają uwodnione jony
Jon sodu (Na+) i jon chloru (Cl-) oddzielają się od siebie i pływają swobodnie w wodzie. Ale nie są samotne!
Każdy jon jest nadal otoczony przez cząsteczki wody. Mówimy, że powstały uwodnione jony: Na+(aq) i Cl-(aq).
"(aq)" oznacza, że jon jest rozpuszczony w wodzie (aqua po łacinie).
To tak, jakby para rozstała się, ale każdy z nich od razu znalazł grupę przyjaciół, która ich otoczyła i wspiera.
Równanie dysocjacji
Cały proces możemy zapisać w postaci równania dysocjacji jonowej:
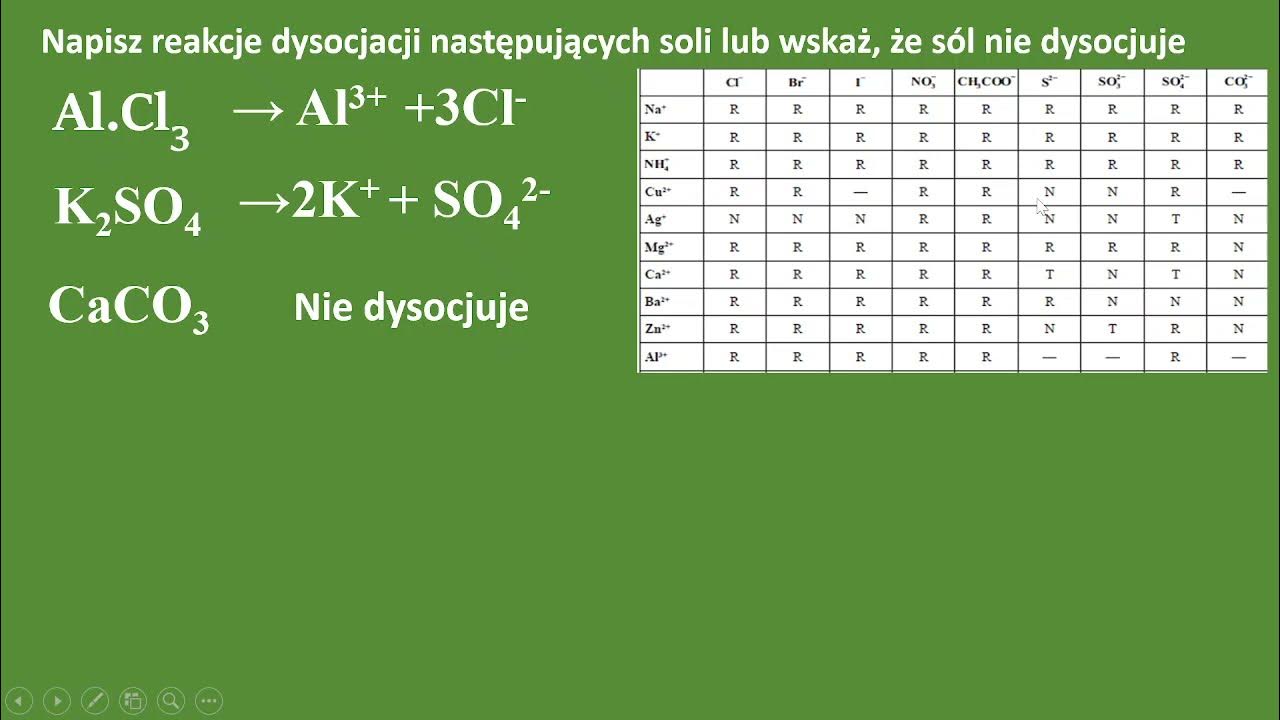
NaCl(s) → Na+(aq) + Cl-(aq)
"(s)" oznacza, że sól jest w stanie stałym (solid po angielsku). Strzałka wskazuje kierunek procesu.
Podsumowując: Kryształ soli (NaCl) pod wpływem wody rozpada się na uwodnione jony sodu (Na+(aq)) i chloru (Cl-(aq)).
Przykłady innych soli
Dysocjacji jonowej ulegają także inne sole, np.:
*KCl(s) → K+(aq) + Cl-(aq) (chlorek potasu)
*MgSO4(s) → Mg2+(aq) + SO42-(aq) (siarczan magnezu)
Zauważ, że ładunki jonów muszą się bilansować. W MgSO4 magnez ma ładunek 2+, a siarczan 2-.
Dlaczego to takie ważne?
Dysocjacja jonowa jest bardzo ważna w wielu procesach chemicznych i biologicznych. Na przykład, elektrolity w naszym ciele to roztwory jonów powstałe w wyniku dysocjacji soli, kwasów i zasad.
Te jony przewodzą prąd elektryczny i są niezbędne do prawidłowego funkcjonowania nerwów i mięśni.
Wyobraź sobie napój izotoniczny. Zawiera on jony, które tracimy podczas wysiłku fizycznego. Dzięki temu możemy szybko uzupełnić straty.
Zapamiętaj! Dysocjacja jonowa to rozpad związku jonowego na jony pod wpływem wody. Woda otacza jony i osłabia siły przyciągania, prowadząc do rozpadu związku.
Mam nadzieję, że teraz dysocjacja jonowa soli jest dla Ciebie bardziej zrozumiała! Powodzenia w dalszej nauce!