Drodzy nauczyciele chemii!
Omówienie położenia pierwiastka w układzie okresowym to fundamentalny element edukacji chemicznej. Warto zadbać o to, by uczniowie zrozumieli to zagadnienie na solidnych podstawach.
Jak skutecznie wprowadzić temat?
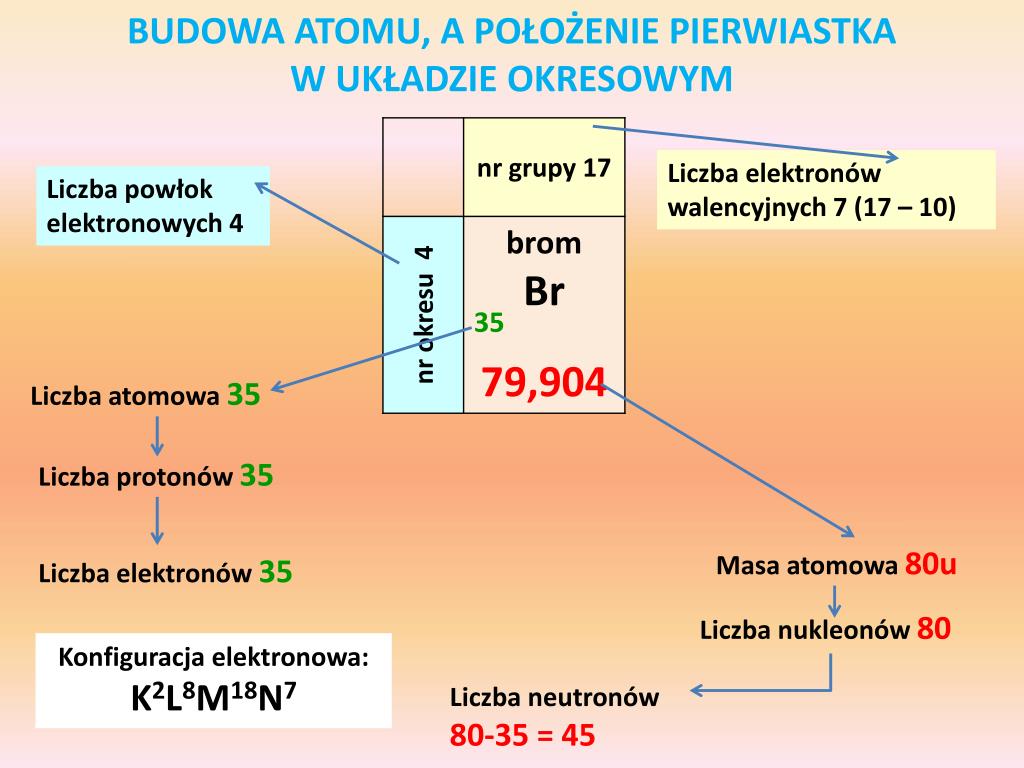
Zacznij od przypomnienia struktury atomu. Wyjaśnij, że liczba atomowa (Z) określa liczbę protonów w jądrze atomu. To właśnie liczba atomowa decyduje o tożsamości pierwiastka. Podkreśl znaczenie tej wartości.
Następnie wprowadź pojęcie układu okresowego pierwiastków. Wyjaśnij, że pierwiastki są w nim uporządkowane według rosnącej liczby atomowej. Zaznacz, że taka organizacja nie jest przypadkowa. Odzwierciedla ona powtarzalność właściwości chemicznych.
Wyjaśnij, co oznaczają grupy (kolumny pionowe) i okresy (rzędy poziome). Zwróć uwagę, że pierwiastki w tej samej grupie mają podobną konfigurację elektronową na powłoce walencyjnej. To przekłada się na podobne właściwości chemiczne. Omów typowe grupy takie jak metale alkaliczne, metale ziem alkalicznych, halogeny i gazy szlachetne. Okres to nic innego jak poziom energetyczny (powłoka) zajmowany przez elektrony w atomie danego pierwiastka.
Korelacja konfiguracji elektronowej i położenia
Kluczowym elementem jest powiązanie konfiguracji elektronowej z położeniem pierwiastka. Pokaż, jak na podstawie konfiguracji elektronowej można określić grupę i okres, w którym znajduje się dany pierwiastek. Rozważ przykłady.
Na przykład, sód (Na) ma konfigurację elektronową 1s2 2s2 2p6 3s1. Oznacza to, że znajduje się w 3 okresie (trzy powłoki elektronowe) i 1 grupie (jeden elektron walencyjny). Podobnie, chlor (Cl) ma konfigurację 1s2 2s2 2p6 3s2 3p5, a więc znajduje się w 3 okresie i 17 grupie (7 elektronów walencyjnych).
Wyjaśnij pojęcie elektronów walencyjnych. Podkreśl, że to one są odpowiedzialne za tworzenie wiązań chemicznych. To właśnie liczba elektronów walencyjnych decyduje o reaktywności pierwiastka. Odnieś się do reguły oktetu i duetu.
Właściwości pierwiastków a położenie
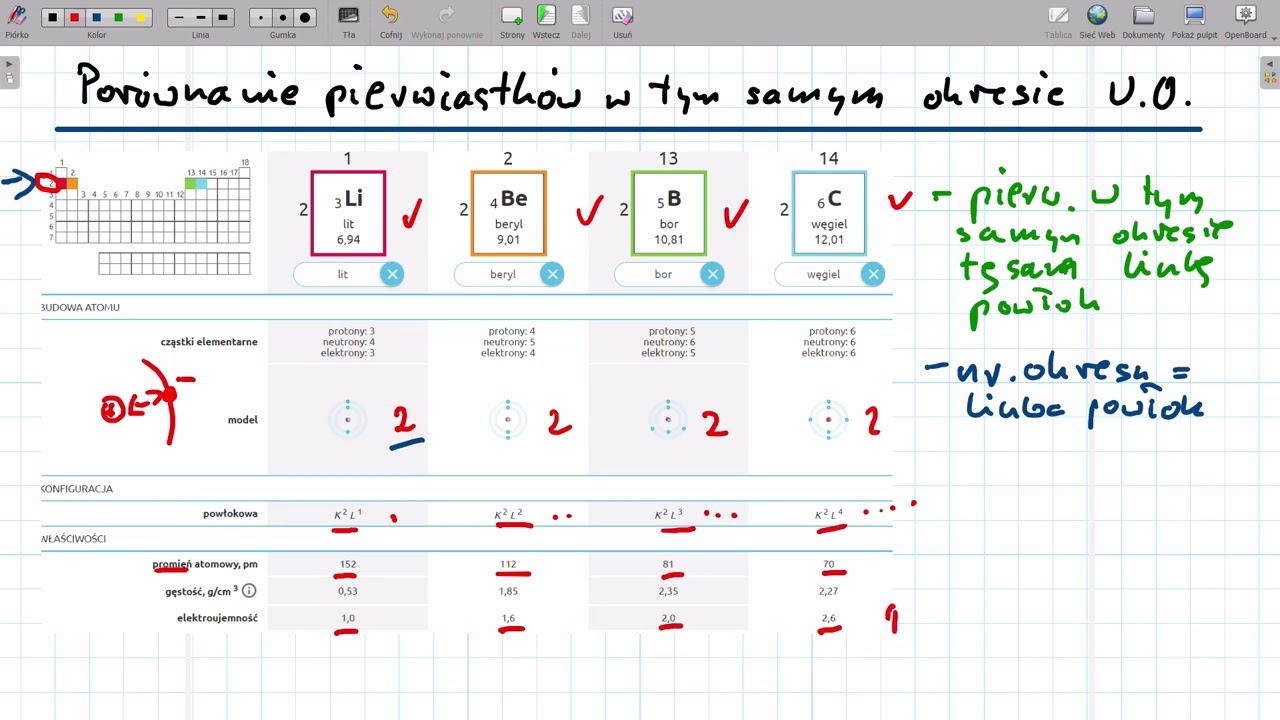
Omów, jak zmieniają się właściwości pierwiastków w grupach i okresach. Wyjaśnij tendencje dotyczące promienia atomowego, energii jonizacji, elektroujemności i charakteru metalicznego. Wyjaśnij i zilustruj zmiany tych parametrów.
Na przykład, promień atomowy rośnie w dół grupy i maleje w prawo w okresie. Energia jonizacji maleje w dół grupy i rośnie w prawo w okresie. Elektroujemność rośnie w prawo w okresie i maleje w dół grupy. Charakter metaliczny rośnie w dół grupy i maleje w prawo w okresie.
Typowe błędy i jak ich unikać
Uczniowie często mylą liczbę atomową z masą atomową. Wyjaśnij to rozróżnienie bardzo dokładnie. Podkreśl, że masa atomowa to średnia ważona mas izotopów.
Inny częsty błąd to mylenie grup i okresów. Stosuj analogie, np. grupy to "kolumny", a okresy to "rzędy". Upewnij się, że uczniowie rozumieją tę różnicę.
Niektórzy uczniowie mają trudności z interpretacją konfiguracji elektronowej. Poświęć więcej czasu na ćwiczenia. Wykorzystaj schematy blokowe i modele atomów. Regularnie sprawdzaj zrozumienie tematu.
Jak uatrakcyjnić lekcję?
Wykorzystaj interaktywne układy okresowe online. Pozwalają one na eksplorację właściwości pierwiastków. Uczniowie mogą samodzielnie odkrywać zależności.
Zaproponuj uczniom stworzenie plakatu lub prezentacji na temat wybranego pierwiastka. Muszą oni uwzględnić jego położenie w układzie okresowym i właściwości.
Zorganizuj quiz lub grę edukacyjną. Możesz wykorzystać kartki z pytaniami, tablicę interaktywną lub aplikacje mobilne. Grywalizacja zwiększa zaangażowanie uczniów.
Przeprowadź eksperymenty, które ilustrują właściwości pierwiastków. Na przykład, reakcja metalu alkalicznego z wodą. Wykaż właściwości kwasowo-zasadowe tlenków, w zależności od położenia w układzie okresowym. Pamiętaj o bezpieczeństwie! Uczeń powinien wiązać położenie pierwiastka w układzie okresowym z właściwościami, które obserwuje.
Pokaż, jak wiedza o układzie okresowym przydaje się w życiu codziennym. Omów zastosowania różnych pierwiastków w technologii, medycynie i przemyśle. Zwróć uwagę, że pierwiastki są wokół nas!
Używaj metafor i analogii. Na przykład, możesz porównać układ okresowy do mapy, która pokazuje "sąsiedztwo" pierwiastków i ich wzajemne relacje. To ułatwia zrozumienie abstrakcyjnych pojęć.
Podsumowanie
Nauczanie o położeniu pierwiastka w układzie okresowym wymaga systematycznego podejścia i uwzględnienia typowych błędów uczniów. Stosowanie różnorodnych metod nauczania i angażowanie uczniów w aktywne uczenie się pomaga w zrozumieniu tego kluczowego zagadnienia chemicznego.
Pamiętaj, że kluczem do sukcesu jest cierpliwość i pozytywne nastawienie. Życzę powodzenia!
Powodzenia w nauczaniu!