Drodzy nauczyciele chemii,
Przygotowałem dla Was artykuł o rozpoznawaniu wzorów soli dobrze rozpuszczalnych w wodzie. Mam nadzieję, że okaże się pomocny w Waszej pracy.
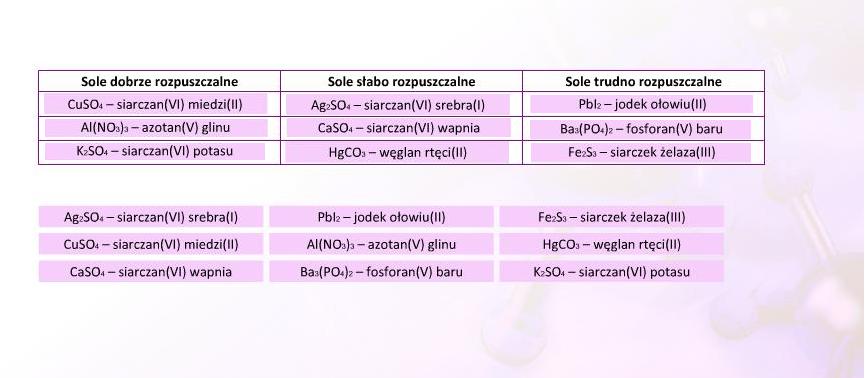
Rozpuszczalność soli: Wprowadzenie
Rozpuszczalność to ważna właściwość substancji.
Określa, ile danej substancji rozpuści się w określonej ilości rozpuszczalnika, np. w wodzie.
Sól, która rozpuszcza się w wodzie w dużej ilości, nazywamy solą dobrze rozpuszczalną.
Kluczowe zasady rozpuszczalności
Rozpuszczalność soli można przewidzieć, opierając się na pewnych ogólnych zasadach.
Nie są to reguły absolutne, ale pozwalają zorientować się w temacie.
Sole litowców (grupa 1)
Z reguły, sole litowców (Li+, Na+, K+, Rb+, Cs+) są dobrze rozpuszczalne w wodzie.
Przykłady: NaCl, KNO3, Li2SO4.
Wyjątki są rzadkie i często omawiane na wyższych poziomach nauczania.
Sole amonowe
Sole amonowe (NH4+) są również zazwyczaj dobrze rozpuszczalne.
Przykład: NH4Cl, (NH4)2SO4.
Azotany
Wszystkie azotany (NO3-) są dobrze rozpuszczalne.
Przykłady: AgNO3, Ca(NO3)2.
Octany
Octany (CH3COO- lub C2H3O2-) są przeważnie rozpuszczalne.
Wyjątkiem jest octan srebra (AgCH3COO), który jest trudno rozpuszczalny.
Chlorki, bromki, jodki
Chlorki (Cl-), bromki (Br-) i jodki (I-) są z reguły rozpuszczalne.
Wyjątki: sole srebra (Ag+), ołowiu (Pb2+) i rtęci (Hg22+).
Na przykład AgCl, PbCl2, Hg2Cl2 są trudno rozpuszczalne.
Siarczany
Siarczany (SO42-) są przeważnie rozpuszczalne.
Wyjątki: siarczany baru (Ba2+), strontu (Sr2+), ołowiu (Pb2+) i wapnia (Ca2+) są słabo rozpuszczalne.
Na przykład BaSO4 jest bardzo trudno rozpuszczalny.
Jak uczyć rozpuszczalności soli?
Wykorzystajcie tabele rozpuszczalności. To dobre narzędzie do weryfikacji przewidywań.
Przeprowadzajcie doświadczenia, które potwierdzą te zasady. Wizualizacja jest bardzo ważna.
Zadawajcie pytania problemowe. "Czy NaCl rozpuści się w wodzie? Dlaczego?"
Analizujcie przykłady z życia codziennego. Gdzie spotykamy rozpuszczalne i nierozpuszczalne sole?
Typowe błędy uczniów
Uczniowie często mylą pojęcia "rozpuszczalny" i "przewodzący prąd". Roztwór soli przewodzi prąd, ale sama rozpuszczalność o tym nie decyduje.
Pamiętajcie, żeby podkreślić, że zasady rozpuszczalności mają wyjątki. Nie są to reguły uniwersalne.
Uczniowie zapominają o ważnych wyjątkach, np. o nierozpuszczalnych chlorkach srebra i ołowiu.
Uatrakcyjnienie lekcji
Wykorzystajcie gry i quizy, aby sprawdzić wiedzę uczniów w zabawny sposób.
Zastosujcie prezentacje multimedialne z interaktywnymi elementami.
Przeprowadzajcie konkursy na najszybsze poprawne rozpoznanie soli rozpuszczalnych i nierozpuszczalnych.
Można przygotować doświadczenie z wytrącaniem osadów różnych soli. To bardzo efektowne.
Wykorzystajcie modelowanie 3D jonów i ich hydratacji, aby pokazać proces rozpuszczania na poziomie molekularnym.
Dodatkowe wskazówki
Podkreślajcie znaczenie rozpuszczalności w kontekście reakcji chemicznych w roztworach wodnych.
Wyjaśnijcie, że rozpuszczalność zależy od temperatury. Większość soli rozpuszcza się lepiej w wyższej temperaturze.
Zachęcajcie uczniów do samodzielnego poszukiwania informacji na temat rozpuszczalności różnych soli.
Dzielcie się przykładami zastosowań praktycznych wiedzy o rozpuszczalności, np. w procesach przemysłowych, w medycynie i w życiu codziennym.
Pamiętajcie o cierpliwości i pozytywnym nastawieniu. Rozpuszczalność soli to obszerny temat, który wymaga czasu i powtórzeń.
Życzę Wam owocnej pracy z uczniami!