Drogi Nauczycielu,
Ten artykuł pomoże Ci w nauczaniu o budowie atomu.
Budowa atomu - wprowadzenie.
Zacznij od podstaw. Wyjaśnij, że wszystko jest zbudowane z atomów.
Atomy są bardzo małe.
Są to podstawowe jednostki materii.
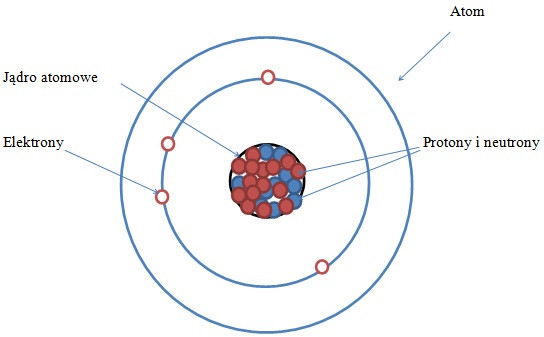
Główne składniki atomu.
Wymień protony, neutrony i elektrony.
Protony mają ładunek dodatni.
Neutrony są neutralne (nie mają ładunku).
Elektrony mają ładunek ujemny.
Jądro atomowe składa się z protonów i neutronów.
Elektrony krążą wokół jądra.
Jądro atomowe.
Wyjaśnij, że jądro atomowe jest bardzo małe, ale gęste.
Zawiera prawie całą masę atomu.
Liczba protonów w jądrze określa, jaki to pierwiastek.
Na przykład, atom wodoru ma jeden proton.
Atom helu ma dwa protony.
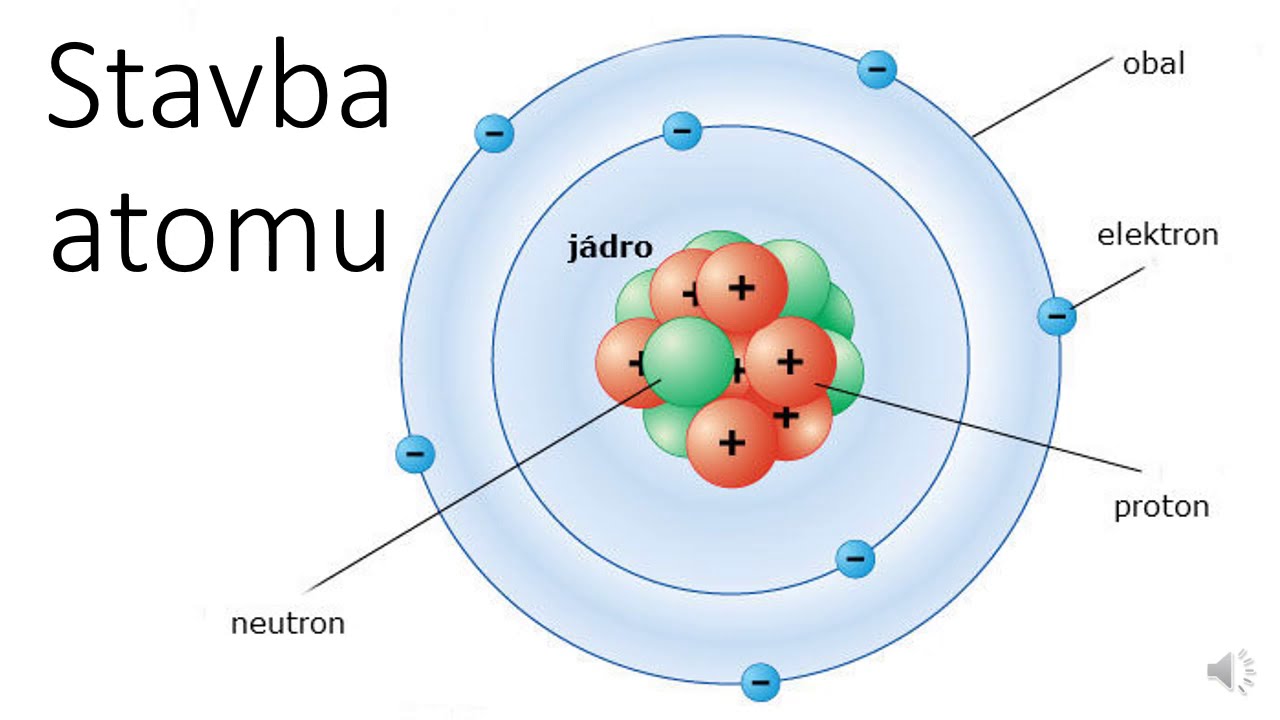
Powłoki elektronowe.
Elektrony nie krążą wokół jądra w sposób przypadkowy.
Zajmują określone poziomy energetyczne, zwane powłokami elektronowymi.
Pierwsza powłoka może pomieścić maksymalnie dwa elektrony.
Druga powłoka może pomieścić maksymalnie osiem elektronów.
I tak dalej.
Jak uczyć o budowie atomu?
Wykorzystaj wizualizacje. Rysunki i modele są bardzo pomocne.
Użyj analogii. Porównaj atom do Układu Słonecznego.
Z protonami, neutronami w roli Słońca a elektronami w roli planet.
Zastosuj gry i quizy.
Wykorzystaj dostępne symulacje online.
Pozwól uczniom na budowanie modeli atomów z dostępnych materiałów.
Częste błędy i nieporozumienia.
Elektrony krążą wokół jądra po dokładnie określonych orbitach.
Uczniowie często myślą, że orbity elektronów są jak orbity planet.
W rzeczywistości, elektrony znajdują się w obszarach przestrzeni zwanych orbitalami.
Atom jest pusty.
Uczniowie często myślą, że atom jest wypełniony materią.
W rzeczywistości, atom składa się głównie z pustej przestrzeni.
Wszystkie atomy tego samego pierwiastka są identyczne.
Uczniowie często zapominają o istnieniu izotopów.
Izotopy to atomy tego samego pierwiastka, ale o różnej liczbie neutronów.
Jak zaangażować uczniów?
Zacznij od ciekawostki. Na przykład, opowiedz o tym, jak odkryto atom.
Wykorzystaj elementy zaskoczenia. Pokaż, jak małe są atomy.
Zastosuj metodę problemową. Zadaj pytanie, na które uczniowie muszą znaleźć odpowiedź.
Na przykład, "Dlaczego niektóre atomy są stabilne, a inne nie?".
Wykorzystaj elementy rywalizacji. Zorganizuj konkurs na najlepszy model atomu.
Pokaż zastosowania wiedzy o atomach. Na przykład, w medycynie, energetyce i technologii.
Wykorzystaj tabelę Mendelejewa. Wyjaśnij, jak jest ona zorganizowana.
Omów liczbę atomową i masę atomową.
Wyjaśnij, jak odczytywać informacje z tabeli Mendelejewa.
Podsumowanie.
Pamiętaj, że nauka o budowie atomu może być fascynująca!
Wykorzystaj różne metody, aby zaangażować uczniów.
Bądź cierpliwy i odpowiadaj na pytania.
Życzę powodzenia!
Przykładowe zadanie: Podkreśl poprawne uzupełnienia zdań dotyczących budowy atomu.
Przykład:
Atom składa się z: a) protonów i elektronów, b) protonów, neutronów i elektronów, c) tylko protonów.
(Poprawna odpowiedź: b)
Zadanie 1:
Ładunek elektryczny protonu jest: a) ujemny, b) obojętny, c) dodatni.
Zadanie 2:
Neutron znajduje się w: a) powłoce elektronowej, b) jądrze atomowym, c) poza atomem.
Zadanie 3:
Liczba protonów w atomie określa: a) masę atomową, b) liczbę neutronów, c) rodzaj pierwiastka.
Zadanie 4:
Elektrony krążą wokół jądra po: a) dowolnych orbitach, b) określonych powłokach, c) w jądrze.
Zadanie 5:
Atom, który ma tyle samo protonów co elektronów jest: a) jonem, b) obojętny elektrycznie, c) zawsze dodatni.