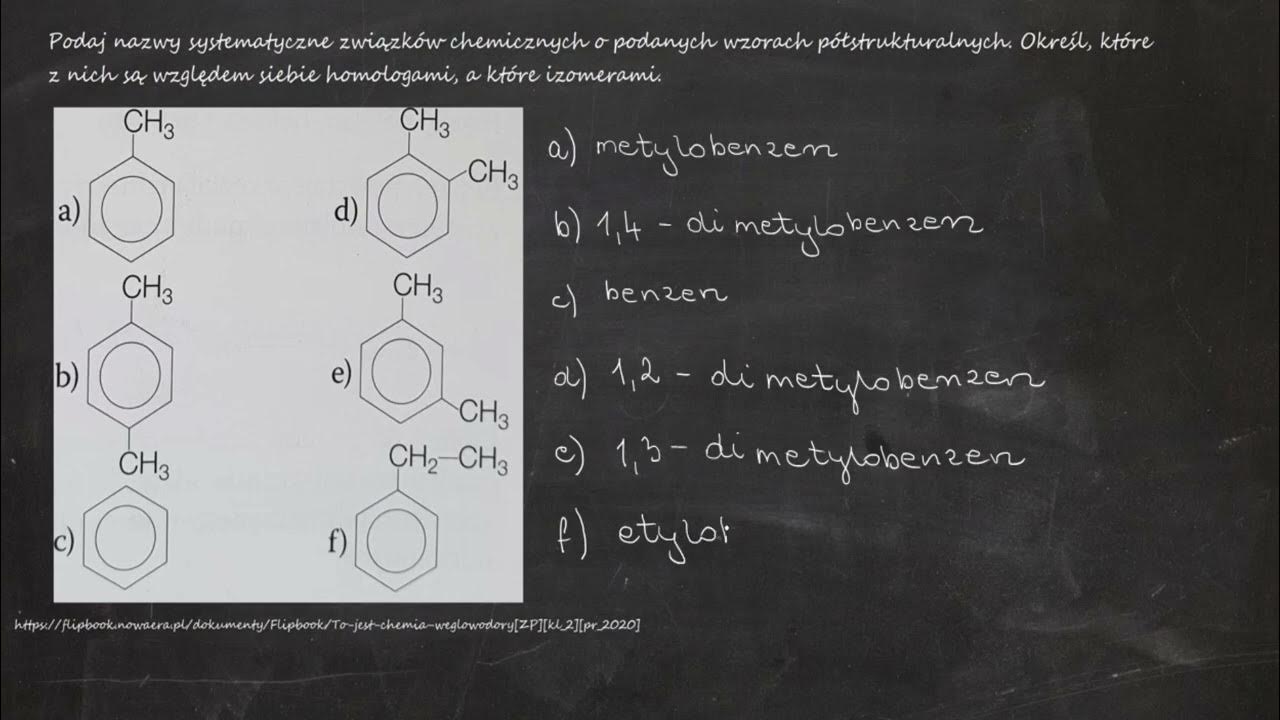
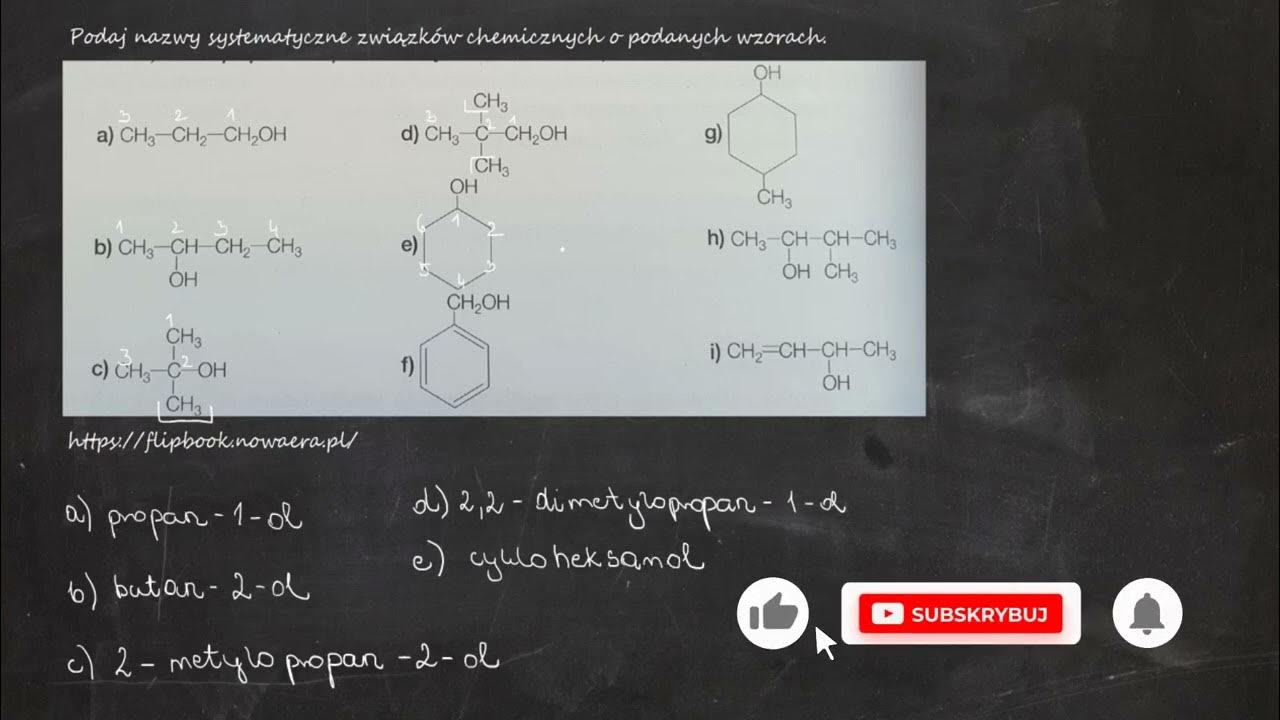
Nazewnictwo związków chemicznych może wydawać się skomplikowane. Ale nie martw się! Zrozumienie kilku podstawowych zasad pozwoli Ci bez problemu czytać i pisać nazwy związków.
Podstawy nazewnictwa
Każdy związek chemiczny ma swoją nazwę systematyczną. To tak jakby miał imię i nazwisko, które precyzyjnie go identyfikują.
Nazwa systematyczna jest tworzona zgodnie z zasadami ustalonymi przez IUPAC (Międzynarodowa Unia Chemii Czystej i Stosowanej). Ta organizacja dba o to, aby wszystkie nazwy były jednoznaczne i zrozumiałe na całym świecie.
Rodzaje związków
Zanim przejdziemy do konkretnych przykładów, musimy rozróżnić kilka podstawowych rodzajów związków chemicznych.
Związki jonowe powstają, gdy atom metalu oddaje elektron atomowi niemetalu. Powstają jony, czyli atomy naładowane dodatnio (kationy) lub ujemnie (aniony).
Związki kowalencyjne (zwane też molekularnymi) powstają, gdy atomy dzielą się elektronami. Zwykle tworzą je dwa niemetale.
Kwasy to związki, które w roztworze wodnym dysocjują na jony wodorowe (H+). Mają kwaśny smak (chociaż nie należy ich próbować!).
Wodorotlenki zawierają grupę hydroksylową (OH-). Reagują z kwasami, tworząc sole.
Sole powstają w wyniku reakcji kwasu z zasadą (lub metalu z kwasem). Chlorek sodu (NaCl), czyli sól kuchenna, to przykład soli.
Nazewnictwo związków jonowych
Nazwy związków jonowych tworzy się, wymieniając najpierw nazwę kationu (jonu dodatniego), a następnie nazwę anionu (jonu ujemnego).
Kationy metali mają takie same nazwy jak pierwiastki, z których powstały. Na przykład, Na+ to jon sodu, a Ca2+ to jon wapnia.
Aniony niemetali tworzy się, dodając do nazwy pierwiastka końcówkę "-ek". Na przykład, Cl- to jon chlorkowy, a O2- to jon tlenkowy.
Przykłady:
- NaCl: chlorek sodu
- MgO: tlenek magnezu
- CaCl2: chlorek wapnia
Jeśli metal tworzy więcej niż jeden typ jonów, konieczne jest podanie wartościowości metalu w nawiasie, cyframi rzymskimi. Na przykład, żelazo tworzy jony Fe2+ i Fe3+.
Przykłady:
- FeCl2: chlorek żelaza(II)
- FeCl3: chlorek żelaza(III)
Nazewnictwo związków kowalencyjnych
W związkach kowalencyjnych, nazwy pierwiastków podaje się w kolejności elektrojemności. Pierwiastek bardziej elektroujemny umieszcza się na końcu nazwy i dodaje końcówkę "-ek".
Aby wskazać ilość atomów danego pierwiastka w cząsteczce, używamy przedrostków liczebnikowych:
- mono- (1) - zwykle pomijany dla pierwszego pierwiastka
- di- (2)
- tri- (3)
- tetra- (4)
- penta- (5)
- heksa- (6)
Przykłady:
- CO2: ditlenek węgla (a nie: tlenek węgla)
- N2O5: pentatlenek diazotu
- PCl5: pentachlorek fosforu
- SF6: heksafluorek siarki
Nazewnictwo kwasów
Nazwy kwasów zależą od tego, czy zawierają tlen.
Kwasy beztlenowe mają w nazwie "kwas" i nazwę anionu z końcówką "-owodorowy".
Przykład:
- HCl: kwas chlorowodorowy
- H2S: kwas siarkowodorowy
Kwasy tlenowe mają w nazwie "kwas" i nazwę anionu pochodzącą od nazwy centralnego atomu, z różnymi końcówkami w zależności od stopnia utlenienia:
- -owy (dla wyższego stopnia utlenienia)
- -awy (dla niższego stopnia utlenienia)
Przykłady:
- H2SO4: kwas siarkowy
- H2SO3: kwas siarkawy
- HNO3: kwas azotowy
- HNO2: kwas azotawy
Nazewnictwo wodorotlenków
Nazwa wodorotlenku składa się z "wodorotlenek" i nazwy metalu. Jeśli metal tworzy jony o różnej wartościowości, podaje się ją w nawiasie, cyframi rzymskimi.
Przykłady:
- NaOH: wodorotlenek sodu
- Ca(OH)2: wodorotlenek wapnia
- Fe(OH)2: wodorotlenek żelaza(II)
- Fe(OH)3: wodorotlenek żelaza(III)
Nazewnictwo soli
Nazwa soli pochodzi od nazwy kwasu, od którego pochodzi anion i nazwy metalu. Podobnie jak w wodorotlenkach, jeśli metal ma więcej niż jedną wartościowość, podajemy ją w nawiasie.
Końcówki anionów pochodzących od kwasów beztlenowych to "-ek".
Końcówki anionów pochodzących od kwasów tlenowych to "-an" (dla kwasów z końcówką "-owy") lub "-in" (dla kwasów z końcówką "-awy").
Przykłady:
- Kwas chlorowodorowy (HCl) -> Chlorek (Cl-) -> NaCl: chlorek sodu
- Kwas siarkowy (H2SO4) -> Siarczan(VI) (SO42-) -> Na2SO4: siarczan(VI) sodu
- Kwas siarkawy (H2SO3) -> Siarczan(IV) (SO32-) -> Na2SO3: siarczan(IV) sodu
- Kwas azotowy (HNO3) -> Azotan(V) (NO3-) -> KNO3: azotan(V) potasu
- Kwas azotawy (HNO2) -> Azotan(III) (NO2-) -> KNO2: azotan(III) potasu
Pamiętaj! Ćwiczenie czyni mistrza. Im więcej przykładów przerobisz, tym łatwiej będzie Ci tworzyć poprawne nazwy związków chemicznych.