Hej! Przygotowujesz się do egzaminu z chemii? Świetnie! Dziś skupimy się na otrzymywaniu wodorotlenku miedzi(II). Nie martw się, przejdziemy przez to krok po kroku. Zobaczysz, że to proste!
Wprowadzenie do Wodorotlenku Miedzi(II)
Wodorotlenek miedzi(II), o wzorze Cu(OH)2, to niebieskie ciało stałe. Jest nierozpuszczalny w wodzie. Znamy go z laboratoriów chemicznych.
Cu(OH)2 ma ciekawe właściwości. Wykorzystuje się go w różnych procesach chemicznych.
Metody Otrzymywania Wodorotlenku Miedzi(II)
Istnieją różne sposoby na otrzymanie Cu(OH)2. Najpopularniejsza metoda to reakcja strąceniowa. Zaraz ją omówimy.
Reakcja Strąceniowa
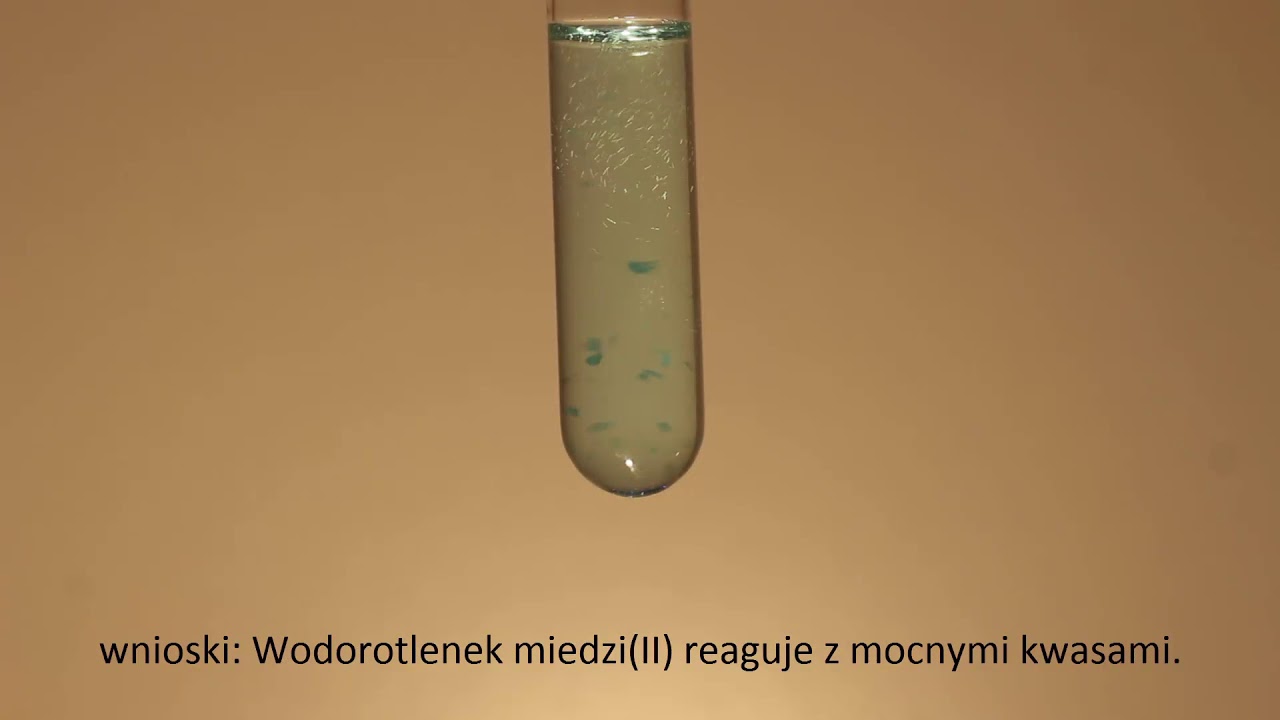
Reakcja strąceniowa to reakcja chemiczna. W jej wyniku powstaje nierozpuszczalny osad. W naszym przypadku, osadem jest Cu(OH)2.
Jak to zrobić? Potrzebujesz roztworu soli miedzi(II). Na przykład, siarczanu(VI) miedzi(II) (CuSO4) lub chlorku miedzi(II) (CuCl2).
Dodajesz do tego roztworu zasadę. Najczęściej używa się wodorotlenku sodu (NaOH) lub wodorotlenku potasu (KOH).
Równanie reakcji dla CuSO4 i NaOH:
CuSO4(aq) + 2NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq)
Równanie reakcji dla CuCl2 i KOH:
CuCl2(aq) + 2KOH(aq) → Cu(OH)2(s) + 2KCl(aq)
Widzisz? Proste! W wyniku reakcji powstaje niebieski osad Cu(OH)2 oraz sól.
Szczegóły Procedury
1. Przygotuj roztwory. Rozpuść sól miedzi(II) w wodzie destylowanej. Osobno rozpuść wodorotlenek (NaOH lub KOH) w wodzie destylowanej.
2. Zmieszaj roztwory. Powoli dodawaj roztwór wodorotlenku do roztworu soli miedzi(II). Mieszaj cały czas!
3. Obserwuj. Powinien pojawić się niebieski osad. To właśnie Cu(OH)2!
4. Przefiltruj. Oddziel osad od roztworu za pomocą sączka.
5. Przemyj. Przemyj osad wodą destylowaną. Usuniesz zanieczyszczenia.
6. Wysusz. Wysusz osad. Możesz użyć suszarki laboratoryjnej lub pozostawić go do wyschnięcia na powietrzu.
Ważne Wskazówki
Używaj wody destylowanej! Unikniesz zanieczyszczeń.
Dodawaj zasadę powoli. Mieszaj cały czas. Zapewnisz równomierne strącanie.
Przemyj osad dokładnie. Usuniesz resztki soli.
Inne Metody Otrzymywania
Reakcja z tlenkiem miedzi(II) (CuO) z wodą jest bardzo powolna. W praktyce się jej nie stosuje. CuO jest słabo reaktywny.
Można też użyć elektrolizy. Ale to bardziej skomplikowane. Zazwyczaj używa się reakcji strąceniowej.
Właściwości i Zastosowania Wodorotlenku Miedzi(II)
Cu(OH)2 jest nierozpuszczalny w wodzie. Ma niebieski kolor. Podczas ogrzewania rozkłada się na tlenek miedzi(II) (CuO) i wodę.
Zastosowania:
Fungicydy (środki grzybobójcze).
Pigmenty.
Katalizator w reakcjach chemicznych.
W laboratoriach chemicznych.
Bezpieczeństwo
Pamiętaj o bezpieczeństwie! Używaj okularów ochronnych i rękawic.
Wodorotlenki są żrące. Unikaj kontaktu ze skórą i oczami.
Pracuj w dobrze wentylowanym pomieszczeniu.
Podsumowanie
Otrzymywanie Cu(OH)2 jest proste! Najczęściej stosuje się reakcję strąceniową.
Kluczowe kroki:
Reakcja soli miedzi(II) z zasadą (NaOH lub KOH).
Powstanie niebieskiego osadu Cu(OH)2.
Filtracja i przemywanie osadu.
Suszenie osadu.
Pamiętaj o:
Użyciu wody destylowanej.
Powolnym dodawaniu zasady i mieszaniu.
Zachowaniu bezpieczeństwa.
Teraz jesteś gotowy! Powodzenia na egzaminie! Wierzę w Ciebie!