Szanowni nauczyciele chemii,
Ten artykuł ma na celu ułatwić Państwu nauczanie zagadnienia otrzymywania wodorotlenków. Przedstawimy metody, typowe błędy uczniów i propozycje na ciekawe lekcje.
Metody otrzymywania wodorotlenków
Wodorotlenki to związki chemiczne, które zawierają grupę hydroksylową (-OH). Istnieje kilka głównych sposobów ich otrzymywania. Omówimy najpopularniejsze metody, które są istotne w programie nauczania. Zaprezentujemy reakcje, które łatwo zademonstrować w klasie.
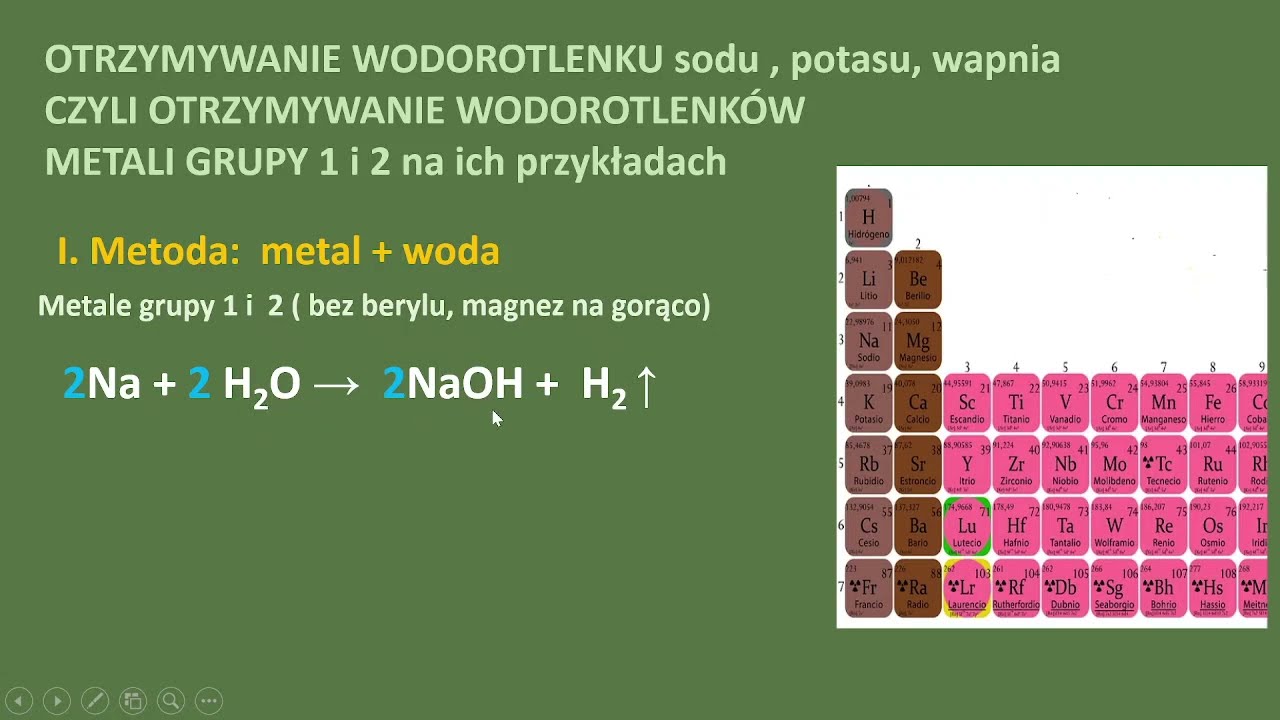
Reakcja aktywnego metalu z wodą
Aktywne metale, takie jak lit, sód, potas, wapń, stront i bar reagują z wodą. Produktem tej reakcji jest wodorotlenek danego metalu i wodór. Reakcja jest egzoenergetyczna, a w przypadku metali alkalicznych nawet bardzo gwałtowna. Zaznaczmy, że reakcja ta nie jest odpowiednia dla wszystkich metali ze względu na ich aktywność chemiczną.
Przykładem jest reakcja sodu z wodą: 2Na + 2H2O → 2NaOH + H2. Demonstrując tę reakcję, należy zachować szczególną ostrożność. Konieczne są środki ochrony osobistej. Uczniom można pokazać film z tą reakcją zamiast przeprowadzać ją na żywo.
Reakcja tlenku metalu z wodą
Tlenki metali alkalicznych i tlenki metali ziem alkalicznych reagują z wodą. W wyniku tej reakcji powstaje wodorotlenek. Na przykład, tlenek wapnia reaguje z wodą, tworząc wodorotlenek wapnia: CaO + H2O → Ca(OH)2. Wodorotlenek wapnia jest znany jako woda wapienna, która jest używana do wykrywania obecności dwutlenku węgla.
Reakcja tlenku wapnia z wodą jest przykładem reakcji gaszenia wapna. Proces ten wydziela ciepło. Uczniowie mogą dotknąć naczynia po reakcji aby poczuć ciepło.
Reakcja soli z zasadą
Reakcja soli z zasadą prowadzi do powstania wodorotlenku. Ważne jest, aby jeden z produktów tej reakcji był nierozpuszczalny w wodzie, aby reakcja zaszła. Przykładem jest reakcja chlorku żelaza(III) z wodorotlenkiem sodu: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl. Powstaje osad wodorotlenku żelaza(III).
Przykładem może być reakcja siarczanu miedzi(II) z wodorotlenkiem sodu: CuSo4 + 2NaOH -> Cu(OH)2 + Na2SO4. W tym przypadku powstaje niebieski osad wodorotlenku miedzi(II). Demonstracja tej reakcji jest bardzo efektowna.
Typowe błędy uczniów
Uczniowie często mylą pojęcia zasada i wodorotlenek. Warto wyjaśnić, że zasada to substancja, która w roztworze wodnym dysocjuje na kation metalu i aniony wodorotlenkowe. Wodorotlenek to związek chemiczny zawierający grupę -OH, ale nie każdy wodorotlenek jest zasadą.
Kolejnym częstym błędem jest niedokładne zapisywanie wzorów chemicznych. Uczniowie zapominają o wartościowości pierwiastków i grup wodorotlenkowych. Należy przypominać o prawidłowym bilansowaniu równań reakcji. Konieczne jest regularne powtarzanie zasad pisania wzorów i bilansowania równań.
Uczniowie często mają problem z przewidywaniem, czy dana reakcja zajdzie. Nie zawsze pamiętają o warunkach koniecznych do zajścia reakcji. Ważne jest, aby podkreślić znaczenie rozpuszczalności substancji w wodzie. Można użyć tabeli rozpuszczalności, aby ułatwić uczniom przewidywanie produktów reakcji.
Jak uatrakcyjnić lekcję
Przeprowadzanie doświadczeń chemicznych jest jednym z najlepszych sposobów na zaangażowanie uczniów. Demonstracje powinny być bezpieczne i efektowne. Można wykorzystać kolorowe reakcje, takie jak powstawanie osadów wodorotlenków metali przejściowych. Wykorzystanie odpowiednich zabezpieczeń jest kluczowe podczas eksperymentów.
Używanie modeli atomów i cząsteczek może pomóc uczniom w zrozumieniu struktury wodorotlenków. Modele 3D pozwalają na lepsze zobrazowanie przestrzenne budowy związków. Można poprosić uczniów o zbudowanie modeli wodorotlenków z dostępnych materiałów, takich jak plastelina lub klocki.
Wykorzystanie multimediów, takich jak filmy i animacje, może uatrakcyjnić lekcję. Można pokazać filmy z przemysłowego otrzymywania wodorotlenków. Animacje mogą pokazywać mechanizmy reakcji na poziomie molekularnym. Dostępnych jest wiele darmowych zasobów edukacyjnych online.
Zorganizowanie quizu lub gry edukacyjnej może pomóc w utrwaleniu wiedzy. Można wykorzystać platformy internetowe do tworzenia interaktywnych quizów. Gry dydaktyczne mogą być dobrą formą powtórki przed sprawdzianem. Należy zadbać o element rywalizacji, który dodatkowo motywuje uczniów.
Przykłady zastosowań wodorotlenków w życiu codziennym sprawiają, że temat staje się bardziej interesujący dla uczniów. Wodorotlenek sodu jest używany do produkcji mydła i papieru. Wodorotlenek wapnia jest używany w budownictwie i rolnictwie. Wodorotlenek magnezu jest składnikiem leków na zgagę. Pokazanie praktycznego zastosowania wiedzy zwiększa zaangażowanie uczniów.
Podsumowanie
Otrzymywanie wodorotlenków to ważny temat w chemii. Zrozumienie tego zagadnienia jest kluczowe do dalszej nauki. Pamiętajmy o jasnym tłumaczeniu, unikaniu typowych błędów i uatrakcyjnianiu lekcji. Wierzymy, że ten artykuł pomoże Państwu w efektywnym nauczaniu chemii.
Życzymy Państwu powodzenia w pracy dydaktycznej!