Ogniwa i elektroliza to dwa bardzo ważne procesy w chemii, które dotyczą zamiany energii chemicznej na elektryczną i odwrotnie. Często pojawiają się na sprawdzianach, więc warto je dobrze zrozumieć!
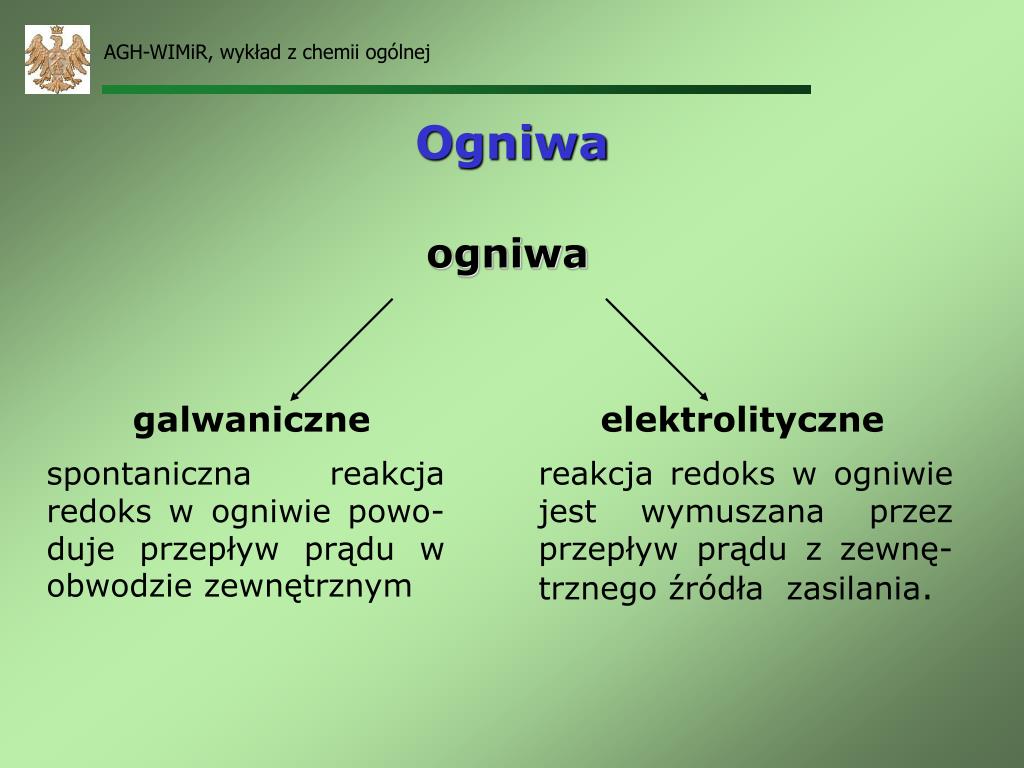
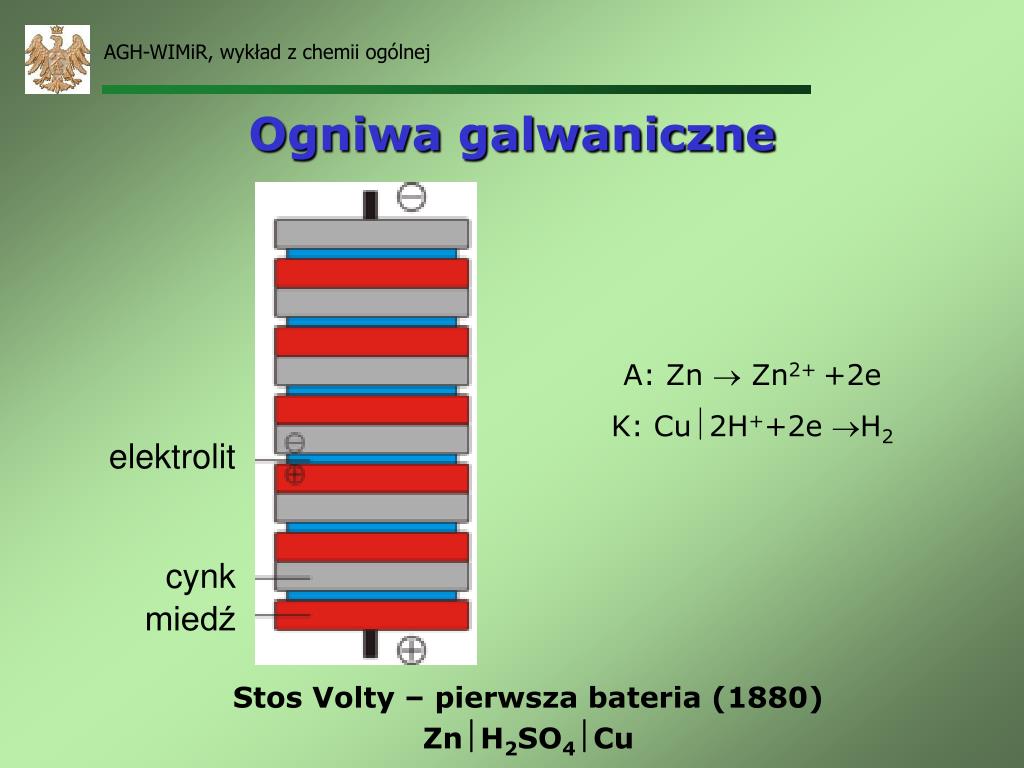
Co to jest ogniwo? Najprościej mówiąc, to urządzenie, które potrafi wytwarzać prąd elektryczny dzięki reakcji chemicznej. Pomyśl o baterii w pilocie do telewizora – to jest właśnie ogniwo! Bateria (ogniwo galwaniczne) zawiera substancje chemiczne, które reagując ze sobą, produkują elektrony, czyli prąd.
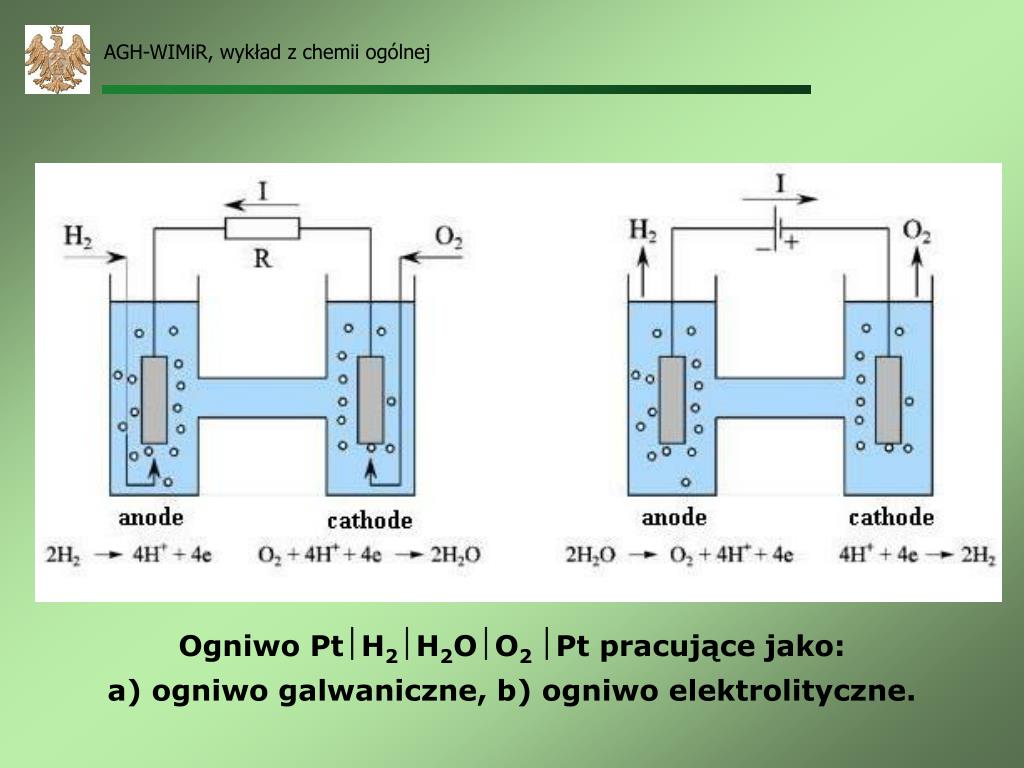
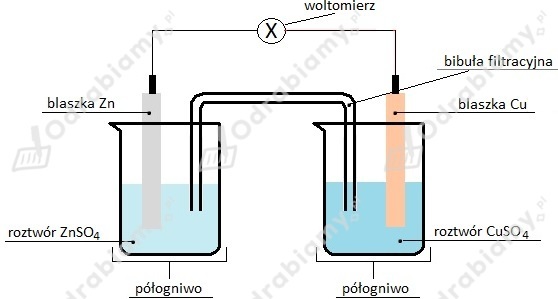
Jak działa ogniwo? Ogniwo zbudowane jest z dwóch elektrod zanurzonych w elektrolicie (roztworze przewodzącym prąd). Na jednej elektrodzie (anodzie) zachodzi utlenianie – oddawanie elektronów. Na drugiej elektrodzie (katodzie) zachodzi redukcja – przyjmowanie elektronów. Elektrony płyną z anody do katody, tworząc prąd w obwodzie.
Co to jest elektroliza? To proces odwrotny do działania ogniwa. W elektrolizie, za pomocą prądu elektrycznego, zmuszamy do zajścia reakcję chemiczną, która normalnie by nie zaszła. Wyobraź sobie, że chcesz rozłożyć wodę na wodór i tlen. Normalnie woda sama się nie rozłoży. Potrzebujesz do tego prądu – podłączasz elektrody do wody i pod wpływem prądu woda zaczyna się rozkładać – to jest właśnie elektroliza!
Jak działa elektroliza? Do elektrolitu (np. roztworu soli) wkładamy dwie elektrody i podłączamy je do źródła prądu. Elektroda podłączona do bieguna dodatniego (+) to anoda, a elektroda podłączona do bieguna ujemnego (-) to katoda. Jony z roztworu (elektrolitu) wędrują do elektrod o przeciwnym znaku i ulegają reakcjom chemicznym.
Dlaczego to ważne? Ogniwa i elektroliza mają bardzo wiele zastosowań! Ogniwa używamy w bateriach, akumulatorach, w samochodach elektrycznych. Elektrolizę stosuje się do oczyszczania metali, galwanizowania (pokrywania metali warstwą innego metalu, np. chromowanie), a także do produkcji wodoru (paliwa przyszłości). Zrozumienie tych procesów jest kluczowe, żeby zrozumieć wiele aspektów otaczającego nas świata.