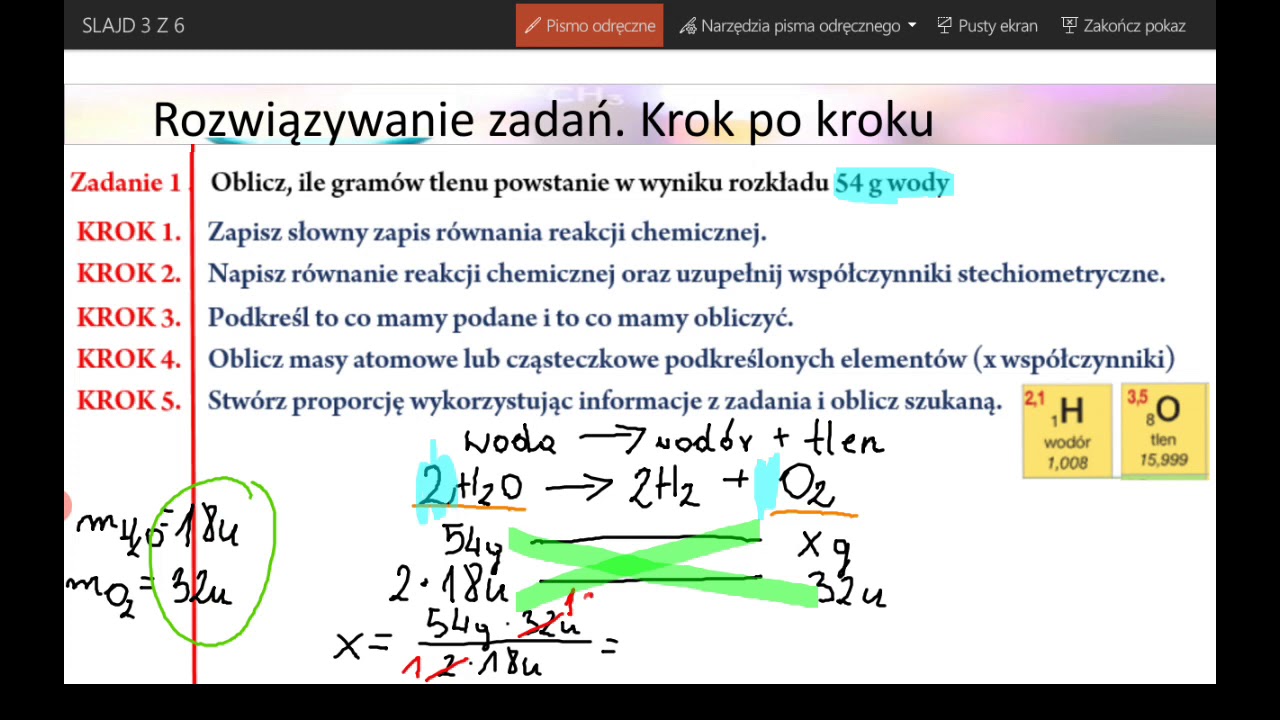
Witaj! Przygotuj się do sprawdzianu z obliczeń stechiometrycznych! To może brzmieć skomplikowanie, ale zaraz zobaczysz, że to nic trudnego.
Zacznijmy od podstaw. Czym jest stechiometria? To dział chemii zajmujący się ilościowymi relacjami między reagentami a produktami w reakcjach chemicznych. Mówiąc prościej, to taka receptura chemiczna, która mówi nam, ile czego potrzebujemy, żeby coś otrzymać.
Podstawowe Pojęcia
Zanim przejdziemy do obliczeń, musimy zrozumieć kilka kluczowych pojęć. Są to masa atomowa, masa cząsteczkowa i mol.
Masa Atomowa
Masa atomowa to masa jednego atomu danego pierwiastka. Znajdziesz ją w układzie okresowym pierwiastków. Jest wyrażana w jednostkach masy atomowej (u). Na przykład, masa atomowa węgla (C) wynosi około 12 u.
Masa Cząsteczkowa
Masa cząsteczkowa to suma mas atomowych wszystkich atomów wchodzących w skład cząsteczki. Obliczamy ją, sumując masy atomowe poszczególnych pierwiastków pomnożone przez ich ilość w cząsteczce. Na przykład, masa cząsteczkowa wody (H2O) wynosi: 2 * masa atomowa wodoru (H) + masa atomowa tlenu (O) = 2 * 1 u + 16 u = 18 u.
Mol
Mol to jednostka ilości materii. Jeden mol zawiera 6,022 x 1023 cząsteczek (lub atomów, jonów, itp.). Ta liczba to liczba Avogadro. Mol to taka duża paczka cząsteczek!
Masa molowa to masa jednego mola danej substancji. Jest wyrażana w gramach na mol (g/mol). Liczbowo, masa molowa jest równa masie atomowej lub cząsteczkowej, ale wyrażonej w gramach. Na przykład, masa molowa węgla (C) wynosi 12 g/mol, a masa molowa wody (H2O) wynosi 18 g/mol.
Równania Chemiczne
Równanie chemiczne to zapis przebiegu reakcji chemicznej. Pokazuje, jakie substancje (reagenty) reagują ze sobą i jakie substancje (produkty) powstają. Ważne jest, aby równanie chemiczne było zbilansowane. Oznacza to, że liczba atomów każdego pierwiastka jest taka sama po obu stronach równania.
Na przykład, reakcja spalania metanu (CH4) w tlenie (O2) prowadzi do powstania dwutlenku węgla (CO2) i wody (H2O). Zbilansowane równanie tej reakcji wygląda tak: CH4 + 2O2 → CO2 + 2H2O. Liczby przed wzorami chemicznymi (np. 2 przed O2 i H2O) to współczynniki stechiometryczne. Mówią nam, w jakim stosunku molowym reagują ze sobą substancje.
Obliczenia Stechiometryczne – Krok po Kroku
Teraz przejdźmy do obliczeń. Obliczenia stechiometryczne pozwalają nam obliczyć, ile produktu powstanie z określonej ilości reagenta, lub ile reagenta potrzebujemy, aby otrzymać określoną ilość produktu.
Oto kroki, które należy wykonać:
- Zapisz zbilansowane równanie reakcji. To podstawa! Bez zbilansowanego równania, obliczenia będą błędne.
- Określ masy molowe substancji, których dotyczą obliczenia. Użyj układu okresowego do znalezienia mas atomowych.
- Przelicz dane masy na mole. Użyj wzoru: liczba moli = masa / masa molowa.
- Ustal stosunek molowy między substancjami, których dotyczą obliczenia, na podstawie współczynników stechiometrycznych z równania reakcji.
- Oblicz liczbę moli szukanej substancji. Użyj stosunku molowego.
- Przelicz liczbę moli na masę. Użyj wzoru: masa = liczba moli * masa molowa.
Przykłady
Spójrzmy na kilka przykładów. Pamiętaj, żeby zawsze zaczynać od zbilansowanego równania reakcji.
Przykład 1: Ile gramów wody powstanie w wyniku spalenia 16 gramów metanu (CH4)?
1. Zbilansowane równanie: CH4 + 2O2 → CO2 + 2H2O
2. Masy molowe: CH4 = 16 g/mol, H2O = 18 g/mol
3. Przeliczamy masę metanu na mole: liczba moli CH4 = 16 g / 16 g/mol = 1 mol
4. Stosunek molowy między CH4 a H2O wynosi 1:2 (z równania reakcji). Oznacza to, że z 1 mola CH4 powstają 2 mole H2O.
5. Obliczamy liczbę moli wody: liczba moli H2O = 1 mol CH4 * 2 = 2 mole
6. Przeliczamy liczbę moli wody na masę: masa H2O = 2 mole * 18 g/mol = 36 g
Odpowiedź: W wyniku spalenia 16 gramów metanu powstanie 36 gramów wody.
Przykład 2: Ile gramów tlenku magnezu (MgO) powstanie w wyniku reakcji 12 gramów magnezu (Mg) z tlenem (O2)?
1. Zbilansowane równanie: 2Mg + O2 → 2MgO
2. Masy molowe: Mg = 24 g/mol, MgO = 40 g/mol
3. Przeliczamy masę magnezu na mole: liczba moli Mg = 12 g / 24 g/mol = 0,5 mola
4. Stosunek molowy między Mg a MgO wynosi 2:2 (czyli 1:1). Oznacza to, że z 2 moli Mg powstają 2 mole MgO.
5. Obliczamy liczbę moli tlenku magnezu: liczba moli MgO = 0,5 mol Mg * 1 = 0,5 mola
6. Przeliczamy liczbę moli tlenku magnezu na masę: masa MgO = 0,5 mola * 40 g/mol = 20 g
Odpowiedź: W wyniku reakcji 12 gramów magnezu z tlenem powstanie 20 gramów tlenku magnezu.
Praktyczne Zastosowania
Obliczenia stechiometryczne są bardzo ważne w chemii. Wykorzystuje się je w wielu dziedzinach, np.:
- W przemyśle chemicznym, do określania ilości reagentów potrzebnych do produkcji określonej ilości produktu.
- W laboratoriach, do przygotowywania roztworów o określonym stężeniu.
- W analizie chemicznej, do określania składu próbek.
- W ochronie środowiska, do obliczania emisji zanieczyszczeń.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć obliczenia stechiometryczne. Pamiętaj o ćwiczeniach! Im więcej zadań rozwiążesz, tym lepiej zrozumiesz te zagadnienia. Powodzenia na sprawdzianie!