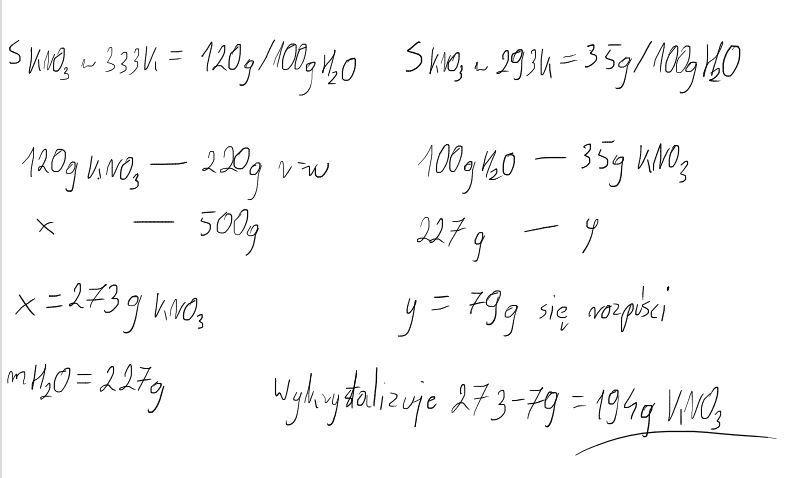Hej! Przygotowujesz się do egzaminu? Świetnie! Pomogę Ci zrozumieć zadania z obliczaniem ilości wody i azotanu(V) potasu. Będzie to proste! Zaczynamy?
Rozpuszczalność – klucz do sukcesu
Najważniejsza jest rozpuszczalność. To ona nam powie, ile substancji rozpuści się w danej ilości wody. Pamiętaj o tym!
Rozpuszczalność zwykle podawana jest w gramach substancji na 100g wody. Musisz ją odczytać z wykresu lub jest podana w zadaniu. To bardzo ważne!
Spójrz na wykres rozpuszczalności azotanu(V) potasu (KNO3). Widzisz? Im wyższa temperatura, tym większa rozpuszczalność.
Przykład z rozpuszczalnością
Załóżmy, że rozpuszczalność KNO3 w 20°C wynosi 32g/100g H2O. Co to oznacza?
Oznacza to, że w 100g wody w temperaturze 20°C można rozpuścić maksymalnie 32g azotanu(V) potasu.
Obliczamy masę wody
Czas na obliczenia! Masę wody obliczysz, jeśli wiesz, ile masz roztworu i jakie jest stężenie procentowe.
Stężenie procentowe (Cp) to masa substancji rozpuszczonej w 100g roztworu.
Jeśli masz roztwór o stężeniu np. 10%, to znaczy, że w 100g tego roztworu jest 10g substancji rozpuszczonej.
Wzór na stężenie procentowe
Wzór na stężenie procentowe wygląda tak: Cp = (ms / mr) * 100%, gdzie:
- Cp - stężenie procentowe
- ms - masa substancji
- mr - masa roztworu
Przykład obliczenia masy wody
Masz 200g roztworu o stężeniu 15%. Ile gramów wody zawiera ten roztwór?
Po pierwsze, oblicz masę substancji: 15% = (ms / 200g) * 100%.
Po przekształceniu wzoru: ms = (15 * 200) / 100 = 30g.
Teraz oblicz masę wody: masa roztworu - masa substancji = masa wody, czyli 200g - 30g = 170g.
W tym roztworze jest 170g wody!
Obliczamy masę azotanu(V) potasu
Mając stężenie i masę roztworu, obliczenie masy azotanu(V) potasu jest proste.
Użyjemy tego samego wzoru na stężenie procentowe! Pamiętaj, żeby dobrze oznaczyć co liczymy.
Przykład obliczenia masy KNO3
Masz 500g roztworu o stężeniu 20% azotanu(V) potasu. Ile gramów KNO3 znajduje się w tym roztworze?
Podstawiamy do wzoru: 20% = (ms / 500g) * 100%.
Przekształcamy wzór: ms = (20 * 500) / 100 = 100g.
W tym roztworze jest 100g azotanu(V) potasu!
Mieszanie roztworów
Czasami zadanie polega na zmieszaniu dwóch roztworów o różnych stężeniach. Tu też damy radę!
Musisz pamiętać, że masa roztworu po zmieszaniu to suma mas poszczególnych roztworów.
Masa substancji po zmieszaniu to suma mas substancji w poszczególnych roztworach.
Przykład mieszania roztworów
Zmieszano 200g roztworu 10% KNO3 z 300g roztworu 15% KNO3. Jakie jest stężenie procentowe otrzymanego roztworu?
Po pierwsze, oblicz masę KNO3 w pierwszym roztworze: 10% = (ms1 / 200g) * 100%, więc ms1 = 20g.
Po drugie, oblicz masę KNO3 w drugim roztworze: 15% = (ms2 / 300g) * 100%, więc ms2 = 45g.
Teraz oblicz masę KNO3 w otrzymanym roztworze: ms = ms1 + ms2 = 20g + 45g = 65g.
Oblicz masę otrzymanego roztworu: mr = 200g + 300g = 500g.
Na koniec oblicz stężenie procentowe otrzymanego roztworu: Cp = (65g / 500g) * 100% = 13%.
Otrzymany roztwór ma stężenie 13%!
Krystalizacja
Krystalizacja to proces wydzielania się substancji w postaci kryształów z roztworu.
Obliczenia związane z krystalizacją są trochę trudniejsze, ale dasz radę!
Pamiętaj o zmianie rozpuszczalności wraz ze zmianą temperatury.
Przykład krystalizacji
Rozpuszczono 100g KNO3 w 200g wody w temperaturze 80°C. Następnie roztwór ochłodzono do 20°C. Ile gramów KNO3 wykrystalizuje, jeśli rozpuszczalność KNO3 w 20°C wynosi 32g/100g H2O?
W temperaturze 20°C w 200g wody można rozpuścić: 2 * 32g = 64g KNO3.
Wykrystalizuje: 100g - 64g = 36g KNO3.
Wykrystalizuje 36g azotanu(V) potasu!
Podsumowanie
Uff! Dużo informacji, ale opanujesz to. Zapamiętaj:
- Rozpuszczalność jest kluczowa. Odczytuj ją z wykresów lub z treści zadania.
- Używaj wzoru na stężenie procentowe: Cp = (ms / mr) * 100%.
- Pamiętaj o jednostkach!
- Mieszając roztwory, sumuj masy roztworów i masy substancji.
- W obliczeniach związanych z krystalizacją uwzględnij zmianę rozpuszczalności wraz z temperaturą.
Powodzenia na egzaminie! Wierzę w Ciebie! Ćwicz, a na pewno wszystko pójdzie dobrze!