Cześć! Przygotujmy się razem do egzaminu z chemii. Skupimy się na reakcji kwasu azotowego i wodorotlenku baru. Będzie dobrze, krok po kroku!
Wprowadzenie do Reakcji
Zaczniemy od podstaw. Reakcja chemiczna to proces, w którym substancje zmieniają się w inne. W naszym przypadku, kwas azotowy (HNO3) reaguje z wodorotlenkiem baru (Ba(OH)2).
Pamiętaj, że ważne jest zrozumienie, co się dzieje na poziomie molekularnym. To pomoże w zapamiętaniu i rozwiązaniu zadań.
Co to jest Kwas i Zasada?
Kwas to substancja, która oddaje jony wodorowe (H+). Zasada to substancja, która przyjmuje jony wodorowe. Kwas azotowy jest silnym kwasem, a wodorotlenek baru jest mocną zasadą.
Reakcja kwasu z zasadą nazywana jest reakcją neutralizacji. Powstaje sól i woda.
Zapis Nierównomiernego Równania
Najpierw zapiszemy równanie reakcji bez współczynników stechiometrycznych. To pomoże nam zobaczyć, jakie substancje biorą udział w reakcji.
HNO3 + Ba(OH)2 → Ba(NO3)2 + H2O
Widzimy, że kwas azotowy reaguje z wodorotlenkiem baru, tworząc azotan baru i wodę.
Identyfikacja Produktów
Azotan baru (Ba(NO3)2) jest solą, która powstaje z kationu baru (Ba2+) i anionu azotanowego (NO3-). Woda (H2O) powstaje z połączenia jonu wodorowego (H+) i jonu wodorotlenkowego (OH-).
Zrozumienie pochodzenia produktów jest kluczowe dla poprawnego zbilansowania równania.
Balansowanie Równania Reakcji
Teraz przejdziemy do balansowania równania. Musimy doprowadzić do sytuacji, w której liczba atomów każdego pierwiastka jest taka sama po obu stronach równania.
Krok 1: Ustalanie Współczynników
Zacznijmy od policzenia atomów azotu (N) po obu stronach. Po lewej stronie mamy jeden atom azotu w kwasie azotowym, a po prawej stronie mamy dwa atomy azotu w azotanie baru.
Dlatego musimy dodać współczynnik 2 przed kwasem azotowym: 2HNO3 + Ba(OH)2 → Ba(NO3)2 + H2O
Krok 2: Balansowanie Wodoru
Teraz policzmy atomy wodoru (H). Po lewej stronie mamy dwa atomy wodoru w kwasie azotowym (2HNO3) i dwa atomy wodoru w wodorotlenku baru (Ba(OH)2), co daje łącznie cztery atomy wodoru. Po prawej stronie mamy dwa atomy wodoru w wodzie.
Dodajemy współczynnik 2 przed wodą: 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O
Krok 3: Sprawdzanie Tlenu i Baru
Na koniec sprawdzamy atomy tlenu (O) i baru (Ba). Po lewej stronie mamy sześć atomów tlenu w kwasie azotowym (2HNO3) i dwa atomy tlenu w wodorotlenku baru (Ba(OH)2), co daje łącznie osiem atomów tlenu. Po prawej stronie mamy sześć atomów tlenu w azotanie baru (Ba(NO3)2) i dwa atomy tlenu w wodzie (2H2O), co daje łącznie osiem atomów tlenu.
Atom baru (Ba) jest zbalansowany – po obu stronach mamy jeden atom.
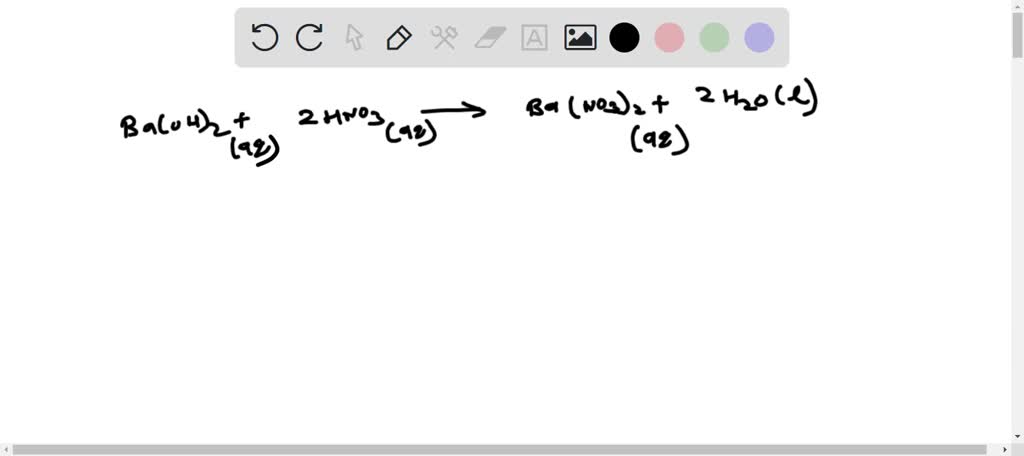
Gotowe Zbalansowane Równanie
Zbalansowane równanie reakcji to:
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O
Podsumowanie i Wskazówki
Pamiętaj! Zawsze zaczynaj od zapisania nierównomiernego równania. Następnie, krok po kroku, ustalaj współczynniki, zaczynając od pierwiastków, które występują w najmniejszej liczbie związków.
Sprawdzaj, czy liczba atomów każdego pierwiastka jest taka sama po obu stronach równania. Jeśli nie, dostosuj współczynniki.
Powodzenia na egzaminie! Wierzę w Ciebie!
Kluczowe Pojęcia
- Kwas azotowy (HNO3): Silny kwas.
- Wodorotlenek baru (Ba(OH)2): Mocna zasada.
- Azotan baru (Ba(NO3)2): Sól powstała w wyniku reakcji.
- Reakcja neutralizacji: Reakcja kwasu z zasadą.
- Balansowanie równania: Doprowadzenie do równości liczby atomów każdego pierwiastka po obu stronach równania.
Dodatkowa rada: ćwicz! Im więcej równań zbilansujesz, tym łatwiej będzie Ci to przychodziło.