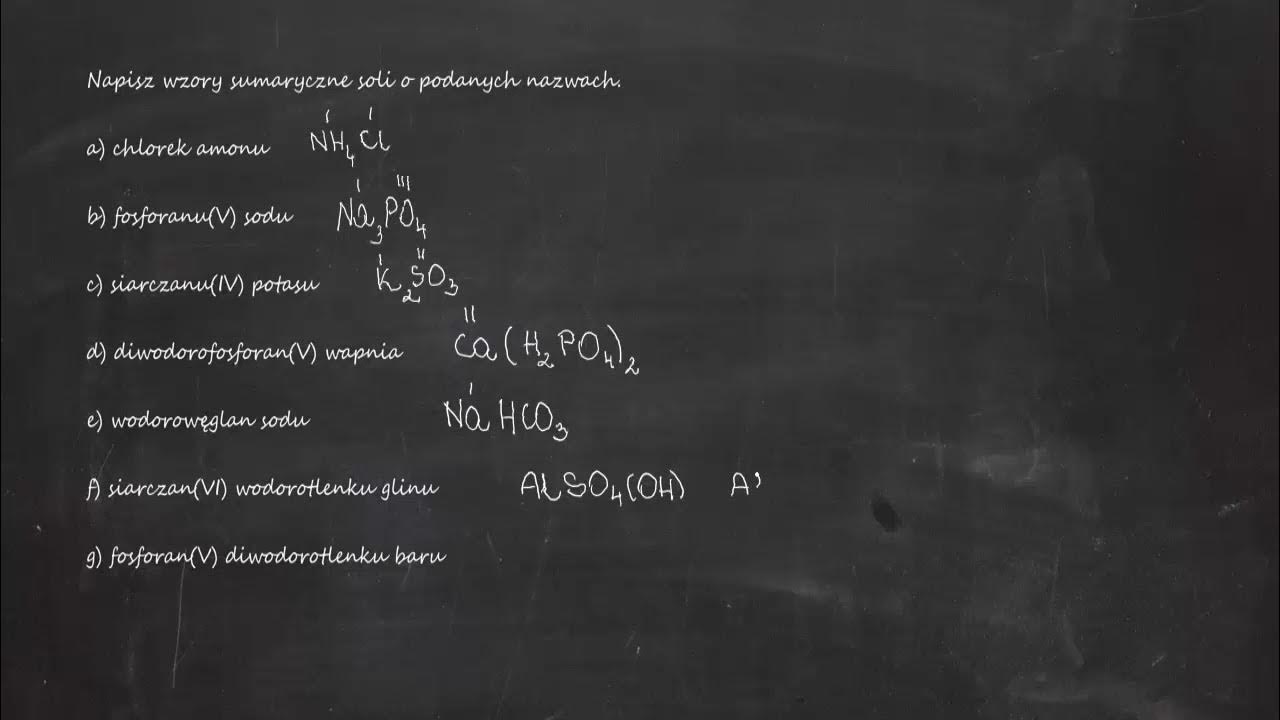Cześć! Chcesz nauczyć się pisać wzory soli na podstawie ich nazw? Świetnie trafiłeś! Zaraz pokażę Ci, jak to zrobić krok po kroku. Będzie prosto i zrozumiale.
Czym są sole?
Zacznijmy od podstaw. Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Ta reakcja nazywa się reakcją zobojętniania. Wyobraź sobie, że masz kwaśny sok z cytryny i chcesz go trochę złagodzić dodając sodę oczyszczoną (zasadę). Produktem tej reakcji będzie sól i woda.
Sole składają się z dwóch części: kationu (jonu dodatniego) i anionu (jonu ujemnego). Kation pochodzi od zasady (często jest to metal), a anion pochodzi od kwasu. Na przykład, w soli kuchennej (chlorku sodu, NaCl), kationem jest jon sodu (Na+), a anionem jest jon chlorkowy (Cl-). Rozumiesz?
Nazewnictwo soli
Nazwa soli składa się z dwóch części: nazwy anionu (pochodzącej od kwasu) i nazwy kationu (pochodzącej od metalu). Ważne jest, żeby znać nazwy popularnych anionów kwasowych. Postaram się je przybliżyć. Pamiętaj, że musimy wiedzieć, z jakiego kwasu dana sól pochodzi, aby poprawnie nazwać anion.
Podstawowe wzory i nazwy kwasów
Aby pisać wzory soli, musisz znać wzory i nazwy kilku podstawowych kwasów. Zacznijmy od tych najczęściej spotykanych.
Kwas solny (chlorowodorowy): HCl. Anion pochodzący od tego kwasu to chlorek (Cl-). Sole tego kwasu to chlorki np. chlorek sodu (NaCl).
Kwas siarkowy(VI): H2SO4. Anion pochodzący od tego kwasu to siarczan(VI) (SO42-). Sole tego kwasu to siarczany(VI) np. siarczan(VI) miedzi(II) (CuSO4).
Kwas siarkowy(IV) (siarkowy(III) - przestarzała nomenklatura): H2SO3. Anion pochodzący od tego kwasu to siarczan(IV) (SO32-). Sole tego kwasu to siarczany(IV) np. siarczan(IV) wapnia (CaSO3).
Kwas azotowy(V): HNO3. Anion pochodzący od tego kwasu to azotan(V) (NO3-). Sole tego kwasu to azotany(V) np. azotan(V) potasu (KNO3).
Kwas węglowy: H2CO3. Anion pochodzący od tego kwasu to węglan (CO32-). Sole tego kwasu to węglany np. węglan wapnia (CaCO3).
Kwas fosforowy(V): H3PO4. Anion pochodzący od tego kwasu to fosforan(V) (PO43-). Sole tego kwasu to fosforany(V) np. fosforan(V) wapnia (Ca3(PO4)2).
Pisanie wzorów soli - krok po kroku
Teraz pokażę Ci, jak pisać wzory soli na podstawie ich nazw. Będziemy to robić na konkretnych przykładach.
Przykład 1: Chlorek potasu
1. Zidentyfikuj kation i anion. Chlorek to anion (Cl-) pochodzący od kwasu solnego (HCl), a potas to kation (K+). Potas leży w pierwszej grupie układu okresowego, a więc tworzy jon z ładunkiem +1. Chlorek ma ładunek -1, bo pochodzi od kwasu chlorowodorowego.
2. Sprawdź wartościowość jonów. Potas ma wartościowość +1, a chlorek -1.
3. Zrównoważ ładunki. W tym przypadku ładunki są już zrównoważone (+1 i -1), więc potrzebujemy po jednym jonie każdego rodzaju. Rozumiesz?
4. Napisz wzór sumaryczny. Wzór chlorku potasu to KCl.
Przykład 2: Siarczan(VI) miedzi(II)
1. Zidentyfikuj kation i anion. Siarczan(VI) to anion (SO42-) pochodzący od kwasu siarkowego(VI) (H2SO4), a miedź(II) to kation miedzi z ładunkiem +2 (Cu2+). Ta rzymska cyfra w nawiasie oznacza wartościowość.
2. Sprawdź wartościowość jonów. Miedź(II) ma wartościowość +2, a siarczan(VI) -2.
3. Zrównoważ ładunki. Ładunki są już zrównoważone (+2 i -2), więc potrzebujemy po jednym jonie każdego rodzaju. Mamy szczęście.
4. Napisz wzór sumaryczny. Wzór siarczanu(VI) miedzi(II) to CuSO4.
Przykład 3: Fosforan(V) wapnia
1. Zidentyfikuj kation i anion. Fosforan(V) to anion (PO43-) pochodzący od kwasu fosforowego(V) (H3PO4), a wapń to kation (Ca2+). Wapń leży w drugiej grupie układu okresowego, więc tworzy jon z ładunkiem +2.
2. Sprawdź wartościowość jonów. Wapń ma wartościowość +2, a fosforan(V) -3.
3. Zrównoważ ładunki. Potrzebujemy najmniejszej wspólnej wielokrotności 2 i 3, czyli 6. Aby uzyskać ładunek +6, potrzebujemy 3 jony wapnia (3 x +2 = +6). Aby uzyskać ładunek -6, potrzebujemy 2 jony fosforanowe(V) (2 x -3 = -6).
4. Napisz wzór sumaryczny. Wzór fosforanu(V) wapnia to Ca3(PO4)2. Pamiętaj o nawiasach, gdy masz więcej niż jeden jon złożony (np. PO43-).
Kilka dodatkowych wskazówek
Pamiętaj o rzymskich cyfrach w nazwach soli. Oznaczają one wartościowość metalu, jeśli metal tworzy jony o różnych wartościowościach (np. miedź(I) i miedź(II)). Żelazo może występować jako żelazo(II) i żelazo(III). Ważne jest, żeby to uwzględnić.
Jeśli masz do czynienia z anionami pochodzącymi od kwasów beztlenowych (np. HCl), nazwa anionu kończy się na "-ek" (np. chlorek, siarczek). Aniony pochodzące od kwasów tlenowych (np. H2SO4) mają końcówki "-an" lub "-yn".
Ćwicz! Im więcej wzorów soli napiszesz, tym łatwiej Ci to przyjdzie. Możesz zacząć od prostych przykładów, a potem przechodzić do bardziej skomplikowanych.
Mam nadzieję, że teraz rozumiesz, jak pisać wzory soli. Powodzenia na lekcjach chemii!