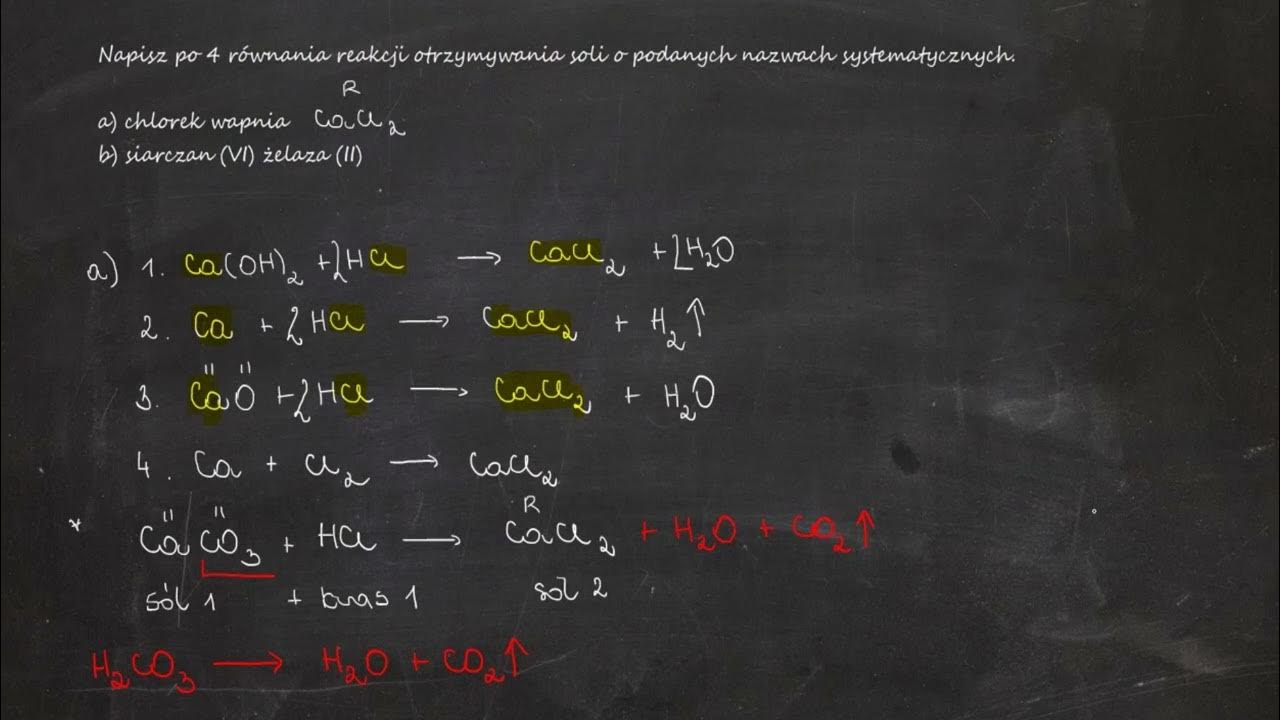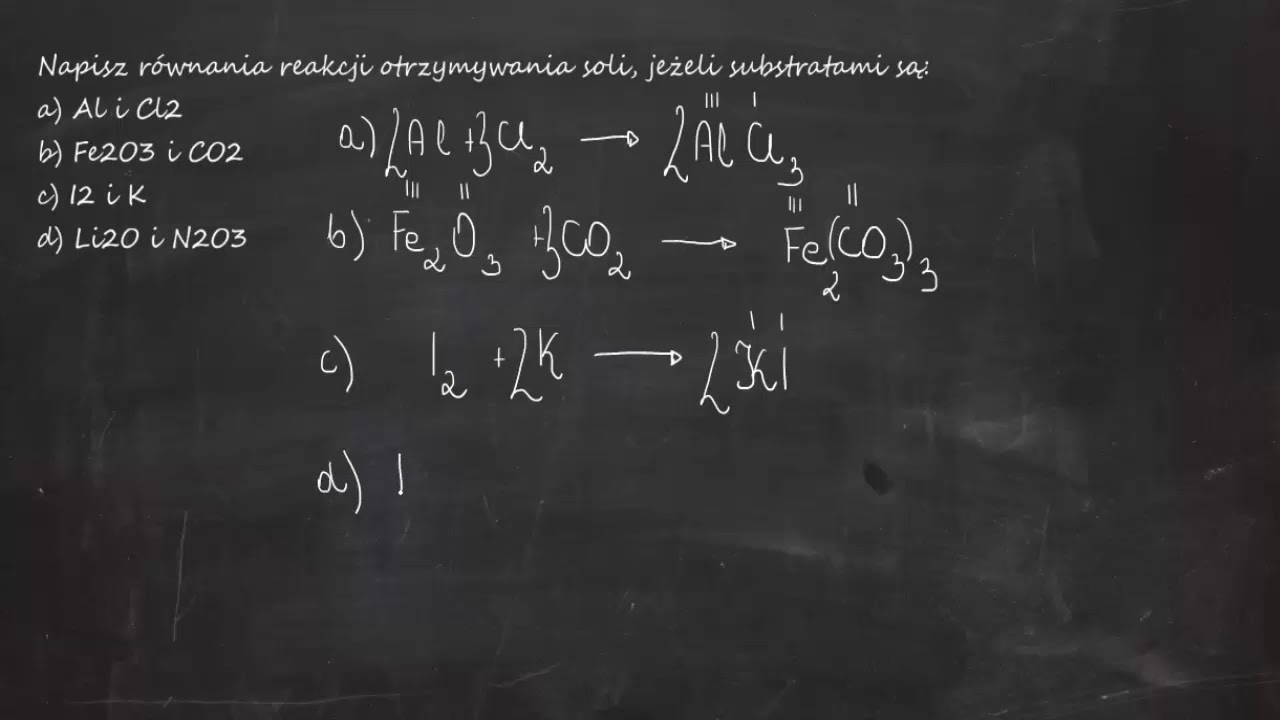Hej! W tym artykule przyjrzymy się, jak powstają sole. Są one wszechobecne w naszym życiu, od soli kuchennej po nawozy. Zrozumienie reakcji ich otrzymywania jest kluczowe w chemii.
Czym są Sole?
Zacznijmy od definicji. Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Mają budowę jonową, co oznacza, że składają się z jonów dodatnich (kationów) i jonów ujemnych (anionów). Sól kuchenna (NaCl), czyli chlorek sodu, to najpopularniejszy przykład.
Kation to jon o ładunku dodatnim. Często jest to metal, np. sód (Na+) lub potas (K+). Anion to jon o ładunku ujemnym. Zazwyczaj jest to niemetal, np. chlor (Cl-) lub siarczan (SO42-).
Wzór ogólny soli to MexRy, gdzie Me to metal (kation), a R to reszta kwasowa (anion). Indeksy x i y oznaczają liczby jonów potrzebnych do zrównoważenia ładunków.
Metody otrzymywania soli
Istnieje wiele sposobów na otrzymywanie soli. Najważniejsze z nich omówimy poniżej. Każda metoda opiera się na innej reakcji chemicznej. Warto pamiętać o bilansowaniu równań reakcji.
1. Reakcja kwasu z zasadą (Neutralizacja)
To chyba najbardziej znana metoda. Neutralizacja to reakcja kwasu z zasadą, w wyniku której powstaje sól i woda. Protony (H+) z kwasu reagują z jonami wodorotlenkowymi (OH-) z zasady tworząc wodę (H2O). Reszta kwasowa z kwasu i kation metalu z zasady tworzą sól.
Przykład: Kwas solny (HCl) reaguje z wodorotlenkiem sodu (NaOH), tworząc chlorek sodu (NaCl) i wodę (H2O).
Równanie reakcji: HCl + NaOH → NaCl + H2O
W tej reakcji kwas solny (HCl) dostarcza jonów Cl-, a wodorotlenek sodu (NaOH) dostarcza jonów Na+. W rezultacie powstaje sól, chlorek sodu (NaCl).
2. Reakcja metalu z kwasem
Metale reagują z kwasami, tworząc sól i wodór. Nie wszystkie metale reagują z kwasami. Aktywność metali określa szereg elektrochemiczny metali.
Przykład: Cynk (Zn) reaguje z kwasem siarkowym (H2SO4), tworząc siarczan cynku (ZnSO4) i wodór (H2).
Równanie reakcji: Zn + H2SO4 → ZnSO4 + H2
Cynk oddaje elektrony, stając się jonem Zn2+. Kwas siarkowy dostarcza jonów SO42-. W efekcie powstaje siarczan cynku.
3. Reakcja tlenku metalu z kwasem
Tlenki metali reagują z kwasami, tworząc sól i wodę. Tlenki metali mają charakter zasadowy.
Przykład: Tlenek miedzi(II) (CuO) reaguje z kwasem solnym (HCl), tworząc chlorek miedzi(II) (CuCl2) i wodę (H2O).
Równanie reakcji: CuO + 2HCl → CuCl2 + H2O
Tlenek miedzi(II) dostarcza jonów Cu2+, a kwas solny dostarcza jonów Cl-. Reakcja prowadzi do powstania chlorku miedzi(II).
4. Reakcja tlenku niemetalu z zasadą
Tlenki niemetali reagują z zasadami, tworząc sól i wodę. Tlenki niemetali mają charakter kwasowy.
Przykład: Tlenek węgla(IV) (CO2) reaguje z wodorotlenkiem sodu (NaOH), tworząc węglan sodu (Na2CO3) i wodę (H2O).
Równanie reakcji: CO2 + 2NaOH → Na2CO3 + H2O
Tlenek węgla(IV) reaguje z jonami OH- z wodorotlenku sodu, tworząc jon węglanowy (CO32-). Następnie jon węglanowy łączy się z jonami Na+, tworząc węglan sodu.
5. Reakcja metalu z niemetalem
Niektóre metale reagują bezpośrednio z niemetalami, tworząc sole. Jest to reakcja utleniania-redukcji.
Przykład: Sód (Na) reaguje z chlorem (Cl2), tworząc chlorek sodu (NaCl).
Równanie reakcji: 2Na + Cl2 → 2NaCl
Sód oddaje elektrony chlorowi. Sód staje się kationem Na+, a chlor staje się anionem Cl-. W wyniku powstaje chlorek sodu.
6. Reakcja soli z kwasem
Sól może reagować z kwasem, tworząc inną sól i inny kwas. Reakcja zachodzi, gdy nowo powstała sól jest nierozpuszczalna lub gdy powstaje słabszy kwas.
Przykład: Chlorek sodu (NaCl) reaguje z kwasem siarkowym (H2SO4), tworząc siarczan sodu (Na2SO4) i kwas solny (HCl).
Równanie reakcji: 2NaCl + H2SO4 → Na2SO4 + 2HCl
Ta reakcja zachodzi w wysokiej temperaturze. Kwas solny jest bardziej lotny niż kwas siarkowy i jest usuwany z mieszaniny reakcyjnej.
7. Reakcja soli z zasadą
Sól może reagować z zasadą, tworząc inną sól i inną zasadę. Reakcja zachodzi, gdy nowo powstała sól jest nierozpuszczalna lub gdy powstaje słabsza zasada.
Przykład: Chlorek żelaza(III) (FeCl3) reaguje z wodorotlenkiem sodu (NaOH), tworząc wodorotlenek żelaza(III) (Fe(OH)3) i chlorek sodu (NaCl).
Równanie reakcji: FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Wodorotlenek żelaza(III) jest nierozpuszczalny w wodzie i wytrąca się z roztworu w postaci osadu.
8. Reakcja soli z solą
Dwie sole mogą reagować ze sobą, tworząc dwie inne sole. Reakcja zachodzi, gdy jedna z nowo powstałych soli jest nierozpuszczalna i wytrąca się z roztworu.
Przykład: Azotan srebra(I) (AgNO3) reaguje z chlorkiem sodu (NaCl), tworząc chlorek srebra(I) (AgCl) i azotan sodu (NaNO3).
Równanie reakcji: AgNO3 + NaCl → AgCl + NaNO3
Chlorek srebra(I) jest nierozpuszczalny w wodzie i tworzy biały osad.
Podsumowanie
Otrzymywanie soli to ważny aspekt chemii. Poznaliśmy różne metody, w tym neutralizację, reakcje metali z kwasami, tlenków z kwasami i zasadami, reakcje metali z niemetalami oraz reakcje między solami, kwasami i zasadami. Pamiętaj o bilansowaniu równań reakcji! Powodzenia!