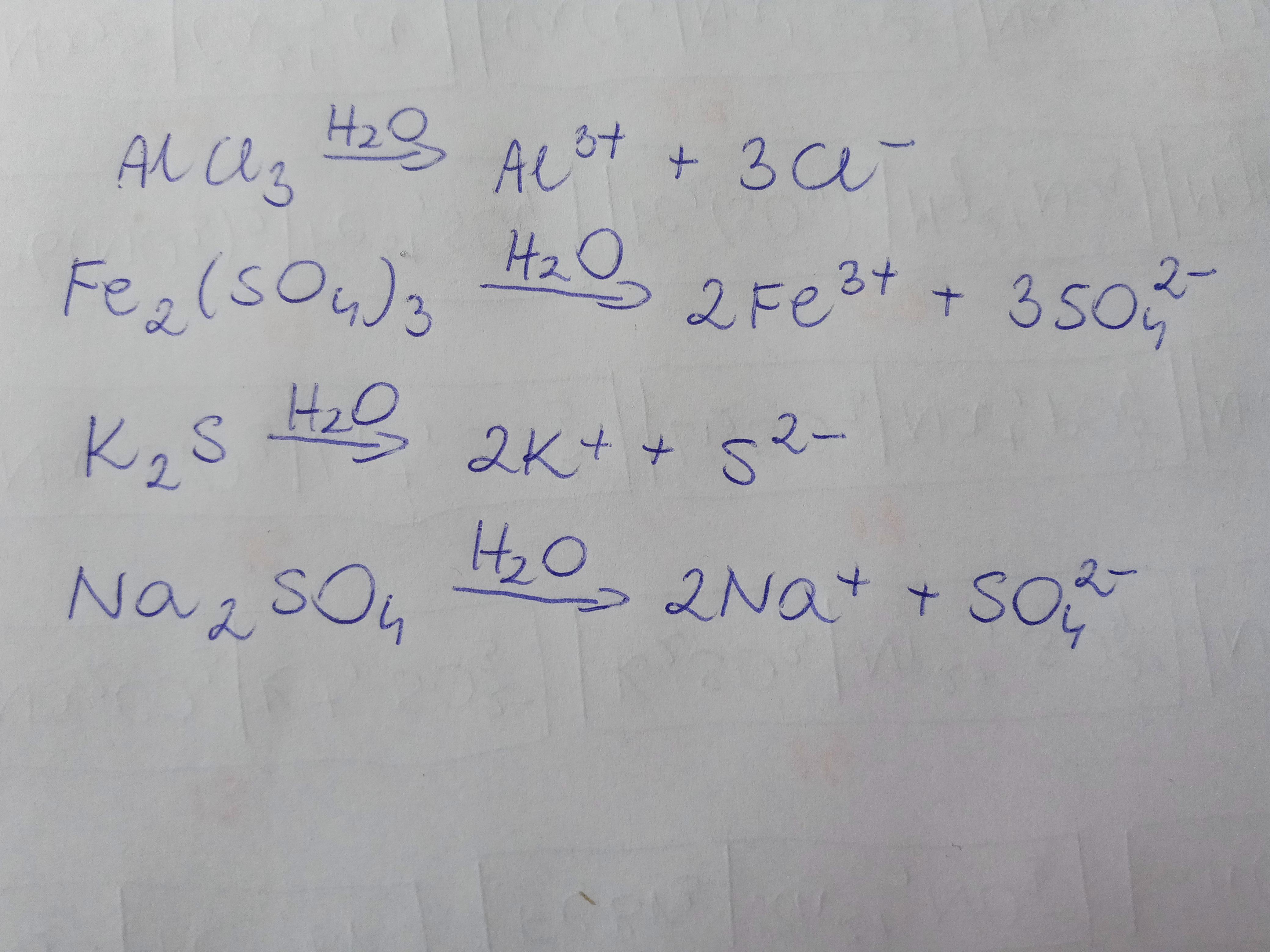Czym jest dysocjacja jonowa?
To rozpad związku chemicznego na jony w roztworze.
Jony to atomy lub grupy atomów z ładunkiem elektrycznym.
Mówimy o kationach (ładunek dodatni) i anionach (ładunek ujemny).
Dysocjacja jonowa soli
Sole to związki jonowe.
Podczas rozpuszczania w wodzie ulegają dysocjacji jonowej.
Proces ten polega na rozpadzie kryształu soli na kationy metalu i aniony reszty kwasowej.
Woda jest rozpuszczalnikiem polarnym.
Cząsteczki wody oddziałują z jonami soli, osłabiając wiązania jonowe.
To prowadzi do rozpadu kryształu i uwolnienia jonów do roztworu.
Jak pisać równania dysocjacji jonowej soli?
Zaczynamy od wzoru sumarycznego soli.
Następnie określamy kation i anion, które powstaną.
Ustalmy ładunki tych jonów.
Na koniec bilansujemy równanie.
Przykłady
Przykład 1: Chlorek sodu (NaCl)
NaCl(s) --(H₂O)--> Na⁺(aq) + Cl⁻(aq)
Chlorek sodu w stanie stałym rozpuszcza się w wodzie.
Powstaje kation sodu (Na⁺) i anion chlorkowy (Cl⁻).
(s) oznacza stan stały.
(aq) oznacza roztwór wodny (aquatic).
Przykład 2: Siarczan potasu (K₂SO₄)
K₂SO₄(s) --(H₂O)--> 2K⁺(aq) + SO₄²⁻(aq)
Siarczan potasu rozpuszcza się w wodzie.
Powstają dwa kationy potasu (2K⁺) i jeden anion siarczanowy (SO₄²⁻).
Ważne jest poprawne zbilansowanie równania.
Przykład 3: Azotan glinu (Al(NO₃)₃)
Al(NO₃)₃(s) --(H₂O)--> Al³⁺(aq) + 3NO₃⁻(aq)
Azotan glinu rozpuszcza się w wodzie.
Powstaje kation glinu (Al³⁺) i trzy aniony azotanowe (3NO₃⁻).
Przykład 4: Węglan wapnia (CaCO₃)
CaCO₃(s) --(H₂O)--> Ca²⁺(aq) + CO₃²⁻(aq)
Węglan wapnia rozpuszcza się w wodzie w niewielkim stopniu.
Powstaje kation wapnia (Ca²⁺) i anion węglanowy (CO₃²⁻).
Zadania do samodzielnego wykonania
Napisz równania dysocjacji jonowej dla następujących soli:
- Bromek magnezu (MgBr₂)
- Fosforan(V) sodu (Na₃PO₄)
- Chlorek żelaza(III) (FeCl₃)
- Siarczan(VI) miedzi(II) (CuSO₄)
- Jodek ołowiu(II) (PbI₂)
Wskazówki
Zidentyfikuj kation i anion w każdej soli.
Określ ich ładunki.
Zbilansuj równanie tak, aby liczba atomów każdego pierwiastka była taka sama po obu stronach.
Pamiętaj o oznaczeniach (s) i (aq).
Znaczenie dysocjacji jonowej
Dysocjacja jonowa jest ważna w wielu procesach chemicznych i biologicznych.
Umożliwia przewodzenie prądu przez roztwory elektrolitów.
Jest niezbędna do funkcjonowania organizmów żywych, np. do transportu jonów przez błony komórkowe.
Wpływa na właściwości roztworów, takie jak pH i ciśnienie osmotyczne.
Elektrolity to substancje, które rozpuszczając się w wodzie, tworzą roztwory przewodzące prąd elektryczny.
Dzieje się tak właśnie dzięki obecności jonów.
Równania dysocjacji jonowej pozwalają zrozumieć, jak powstają te jony i jakie są ich stężenia w roztworze.
Znajomość tych procesów jest kluczowa w wielu dziedzinach nauki i techniki.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć, jak pisać równania dysocjacji jonowej soli.
Powodzenia w dalszej nauce!