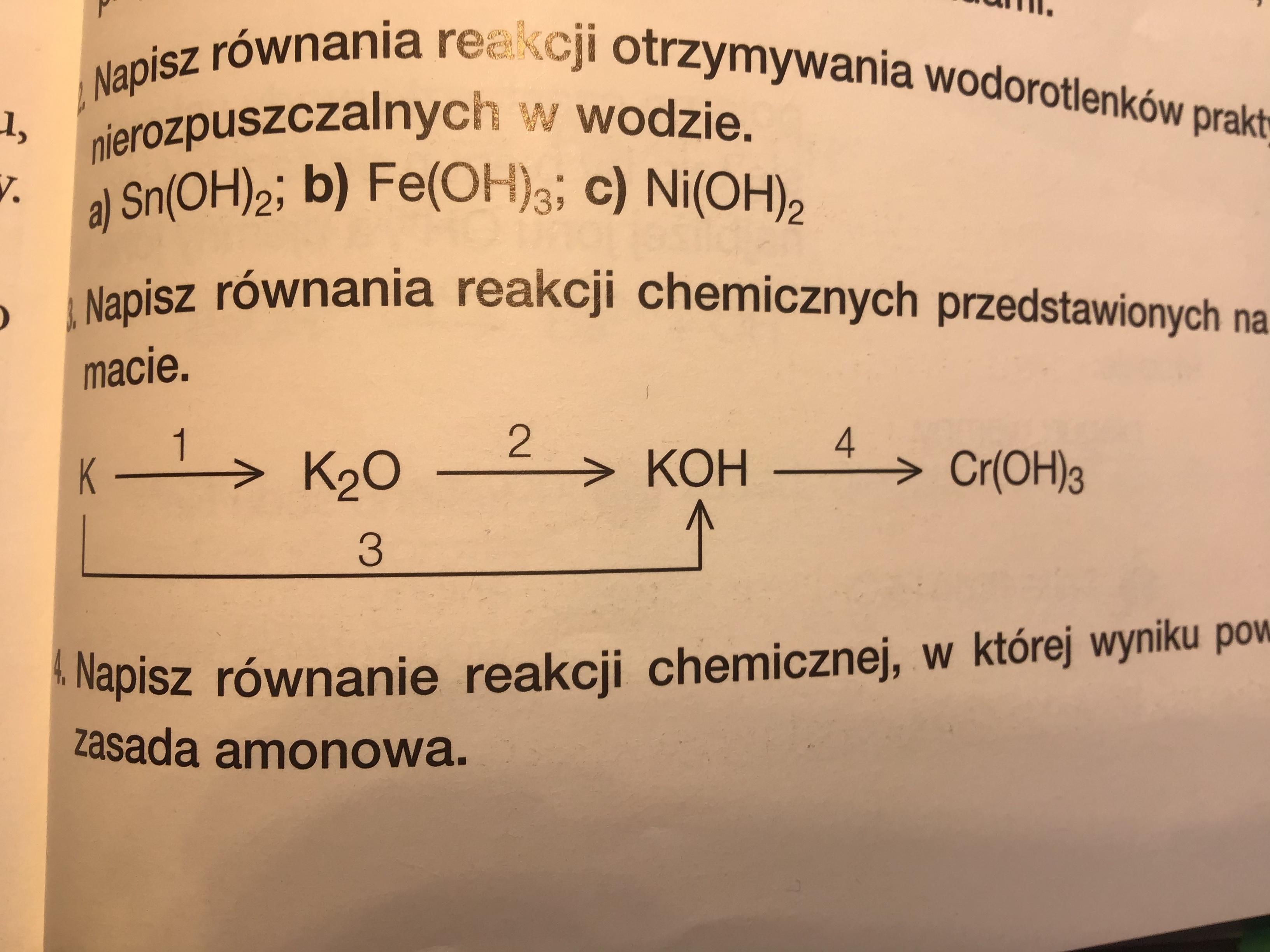
Zajmiemy się teraz pisaniem równań reakcji chemicznych na podstawie schematu.
Wyobraź sobie, że schemat to mapa drogowa.
Każda strzałka na tej mapie to reakcja chemiczna.
Jak to działa?
Musisz zidentyfikować substraty i produkty.
Substraty to to, z czego zaczynasz, jak składniki dania.
Produkty to to, co otrzymujesz, gotowe danie.
Reakcja chemiczna: Substraty → Produkty
Strzałka (→) oznacza „reaguje, tworząc”.
Na przykład, wodór (H2) reaguje z tlenem (O2), tworząc wodę (H2O).
Równanie chemiczne
Równanie chemiczne zapisujemy tak: H2 + O2 → H2O
Ale to jeszcze nie koniec!
Musimy zbilansować równanie.
To znaczy, że liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania.
Pomyśl o tym jak o równowadze na wadze.
2H2 + O2 → 2H2O
Teraz mamy 4 atomy wodoru (H) i 2 atomy tlenu (O) po obu stronach równania.
Przykłady
Rozważmy przykład spalania metanu (CH4).
Metan reaguje z tlenem (O2), tworząc dwutlenek węgla (CO2) i wodę (H2O).
Nierozwiązane równanie: CH4 + O2 → CO2 + H2O
Bilansujemy węgiel (C): Jest 1 atom węgla po obu stronach. OK.
Bilansujemy wodór (H): Są 4 atomy wodoru po lewej i 2 po prawej.
Dodajemy 2 przed H2O: CH4 + O2 → CO2 + 2H2O
Bilansujemy tlen (O): Są 2 atomy tlenu po lewej i 4 po prawej.
Dodajemy 2 przed O2: CH4 + 2O2 → CO2 + 2H2O
Teraz równanie jest zbilansowane.
Spójrz na to jak na przepis kulinarny: potrzebujesz odpowiedniej ilości składników, aby otrzymać odpowiedni produkt.
Inne rodzaje reakcji
Synteza (łączenie): A + B → AB
Przykład: 2H2 + O2 → 2H2O (wodór i tlen łączą się, tworząc wodę)
Rozkład: AB → A + B
Przykład: 2H2O → 2H2 + O2 (woda rozkłada się na wodór i tlen – elektroliza)
Wymiana pojedyncza: A + BC → AC + B
Przykład: Zn + CuSO4 → ZnSO4 + Cu (cynk wypiera miedź z siarczanu miedzi)
Wymiana podwójna: AB + CD → AD + CB
Przykład: AgNO3 + NaCl → AgCl + NaNO3 (azotan srebra reaguje z chlorkiem sodu, tworząc chlorek srebra i azotan sodu)
Praktyczne wskazówki
Zacznij od najprostszych atomów: węgiel, wodór, tlen.
Często zacznij od pierwiastków, które występują tylko w jednym związku po każdej stronie równania.
Jeśli masz grupę poliatomową (np. SO42-), traktuj ją jako całość, jeśli występuje po obu stronach.
Używaj ułamków, aby tymczasowo zbilansować równanie, a następnie pomnóż całe równanie przez mianownik, aby pozbyć się ułamków.
Sprawdź na koniec, czy liczba atomów każdego pierwiastka jest taka sama po obu stronach równania.
Przykładowy schemat
Załóżmy, że mamy schemat: A → B → C
A to substrat, B to produkt pośredni, a C to produkt końcowy.
Pierwsza reakcja: A → B
Druga reakcja: B → C
Jeśli A = CH4, B = CO, a C = CO2, to reakcje będą wyglądały tak:
Reakcja 1: 2CH4 + 3O2 → 2CO + 4H2O (niepełne spalanie metanu)
Reakcja 2: 2CO + O2 → 2CO2 (spalanie tlenku węgla do dwutlenku węgla)
Pamiętaj, ćwiczenie czyni mistrza!
Im więcej będziesz rozwiązywać zadań, tym łatwiej będzie Ci pisać i bilansować równania reakcji chemicznych.
Traktuj to jako rozwiązywanie zagadek, gdzie musisz znaleźć odpowiednie liczby i umieścić je we właściwych miejscach.
Powodzenia!