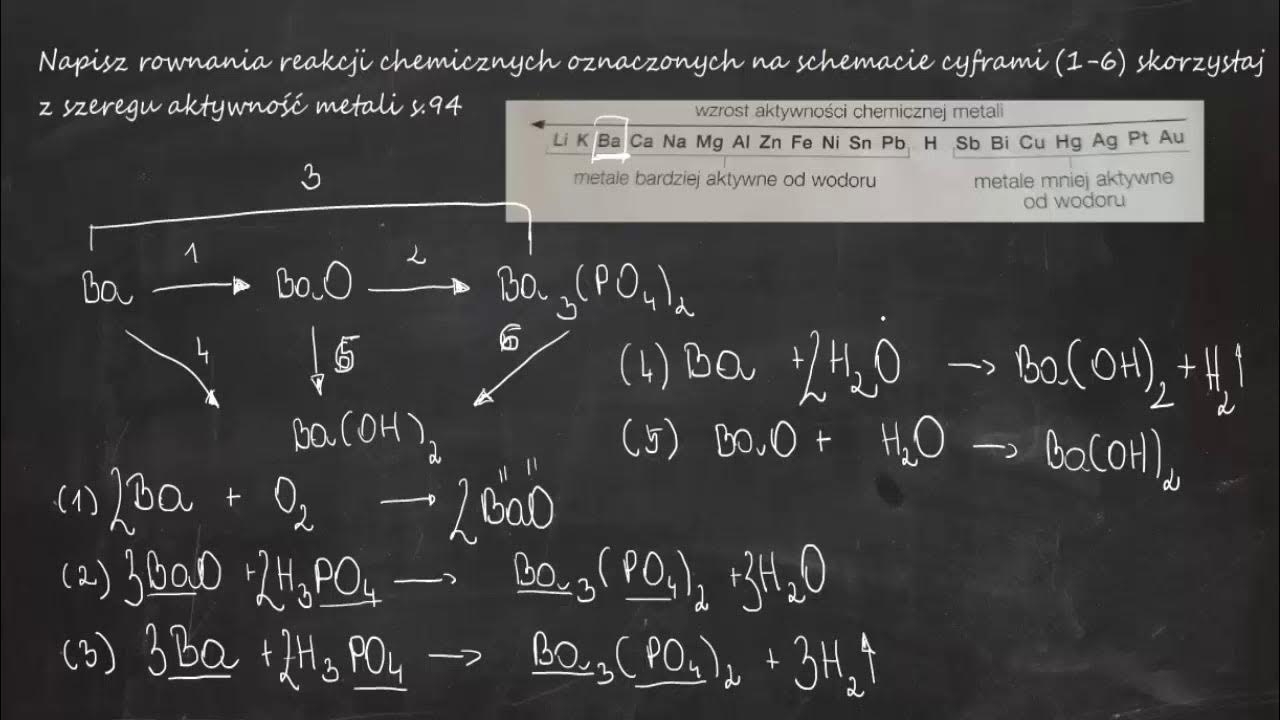Cześć! Przygotujmy się razem do rozwiązywania zadań ze schematami reakcji chemicznych. Będziemy pisać równania reakcji oznaczonych cyframi. To wcale nie jest takie trudne, jak się wydaje!
Analiza Schematu Reakcji
Pierwszy krok to dokładna analiza schematu. Spójrz, co jest na początku, co na końcu. Zwróć uwagę na substraty i produkty każdej reakcji.
Zastanów się, jakie odczynniki są użyte w reakcji. Czy jest to kwas, zasada, katalizator? To bardzo ważne!
Czy widzisz jakieś warunki reakcji? Wysoka temperatura, ciśnienie, światło? To też wpływa na przebieg reakcji.
Przykład
Załóżmy, że mamy schemat: A --(1)--> B --(2)--> C. A to substrat początkowy, C to produkt końcowy. Reakcja (1) przekształca A w B, a reakcja (2) przekształca B w C.
Pisemne Równania Reakcji
Teraz czas na pisanie równań. Zacznij od reakcji (1). Zidentyfikuj, jakie związki biorą udział w reakcji. Napisz je po lewej stronie równania (substraty).
Po prawej stronie równania umieść produkty reakcji (1). Sprawdź, czy wszystko się zgadza. Zwróć uwagę na wzory sumaryczne i strukturalne.
Kolejny krok to uzgodnienie równania. Musisz zadbać o to, by liczba atomów każdego pierwiastka była taka sama po obu stronach równania.
Uzgadnianie Równań
Zacznij od pierwiastków, które występują tylko w jednym związku po każdej stronie równania. Zwykle zaczyna się od metali lub niemetali innych niż tlen i wodór.
Następnie uzgodnij atomy tlenu i wodoru. Pamiętaj, że czasami trzeba użyć współczynników stechiometrycznych.
Jeżeli reakcja zachodzi w roztworze wodnym, sprawdź, czy równanie jest zbilansowane pod względem ładunku. Suma ładunków po obu stronach musi być taka sama.
Przykład
Załóżmy, że reakcja (1) to spalanie metanu: CH4 + O2 --> CO2 + H2O.
Uzgodnione równanie wygląda tak: CH4 + 2O2 --> CO2 + 2H2O.
Reakcja (2) i Kolejne
Powtórz te same kroki dla reakcji (2) i wszystkich kolejnych reakcji w schemacie. Pamiętaj, że produkt jednej reakcji może być substratem kolejnej.
Bądź uważny! Czasami trzeba uwzględnić warunki reakcji, na przykład obecność katalizatora. Katalizator zapisuje się nad strzałką reakcji.
Jeżeli reakcja jest odwracalna, użyj podwójnej strzałki (⇌) zamiast pojedynczej (→).
Przykładowa Reakcja Odwracalna
N2 + 3H2 ⇌ 2NH3 (reakcja Habera-Boscha).
Rodzaje Reakcji
Warto rozpoznać różne rodzaje reakcji chemicznych. To pomoże ci przewidzieć produkty reakcji.
- Reakcje syntezy: Dwa lub więcej substratów łączą się w jeden produkt (A + B --> C).
- Reakcje analizy: Jeden substrat rozkłada się na dwa lub więcej produktów (A --> B + C).
- Reakcje wymiany: Atomy lub grupy atomów wymieniają się między substratami (A + BC --> AC + B).
- Reakcje utleniania-redukcji (redoks): Następuje zmiana stopni utlenienia atomów.
- Reakcje zobojętniania: Kwas reaguje z zasadą, tworząc sól i wodę.
Przykłady Równań Reakcji
Oto kilka przykładów równań reakcji, które mogą się przydać:
- Spalanie węgla: C + O2 --> CO2
- Reakcja kwasu solnego z magnezem: Mg + 2HCl --> MgCl2 + H2
- Reakcja wodorotlenku sodu z kwasem siarkowym: 2NaOH + H2SO4 --> Na2SO4 + 2H2O
- Elektroliza wody: 2H2O --> 2H2 + O2
Wskazówki i Triki
Ćwicz, ćwicz, ćwicz! Im więcej zadań rozwiążesz, tym lepiej zrozumiesz schematy reakcji.
Zawsze sprawdzaj, czy równanie jest uzgodnione. To podstawa!
Używaj kartki papieru i ołówka. Notuj, rysuj, obliczaj. To pomaga!
Jeśli masz problem, poproś o pomoc nauczyciela lub kolegę. Nie bój się pytać!
Pamiętaj, żeby zwracać uwagę na nazewnictwo związków chemicznych. Znać nazwy i wzory kwasów, zasad i soli.
Podsumowanie
Pamiętaj o kilku kluczowych krokach:
- Analizuj schemat reakcji.
- Pisz równania reakcji, uwzględniając substraty i produkty.
- Uzgadniaj równania reakcji.
- Rozpoznawaj rodzaje reakcji.
- Ćwicz regularnie!
Dasz radę! Powodzenia na egzaminie!