Zaczniemy od wyjaśnienia, czym są kwasy. Kwasy to związki chemiczne, które w roztworach wodnych dysocjują, tworząc jony wodorowe (H+).
Wzory sumaryczne kwasów informują nas o rodzaju i liczbie atomów wchodzących w skład cząsteczki kwasu.
Kwasy Beztlenowe
Są to kwasy, które w swojej budowie nie zawierają atomów tlenu.
Nazewnictwo kwasów beztlenowych
Nazwę tworzymy od słowa "kwas" i nazwy niemetalu z końcówką "-owodorowy".
Przykład 1: HCl
Wzór sumaryczny HCl to kwas chlorowodorowy.
Przykład 2: HBr
Wzór sumaryczny HBr to kwas bromowodorowy.
Przykład 3: HF
Wzór sumaryczny HF to kwas fluorowodorowy.
Przykład 4: H2S
Wzór sumaryczny H2S to kwas siarkowodorowy.
Kwasy beztlenowe występują zazwyczaj w roztworach wodnych.
Kwasy Tlenowe
Są to kwasy, które w swojej budowie zawierają atomy tlenu.
Nazewnictwo kwasów tlenowych
Nazewnictwo jest bardziej złożone niż w przypadku kwasów beztlenowych. Opiera się na stopniu utlenienia atomu centralnego (niemetalu).
Rozważmy kilka popularnych kwasów tlenowych.
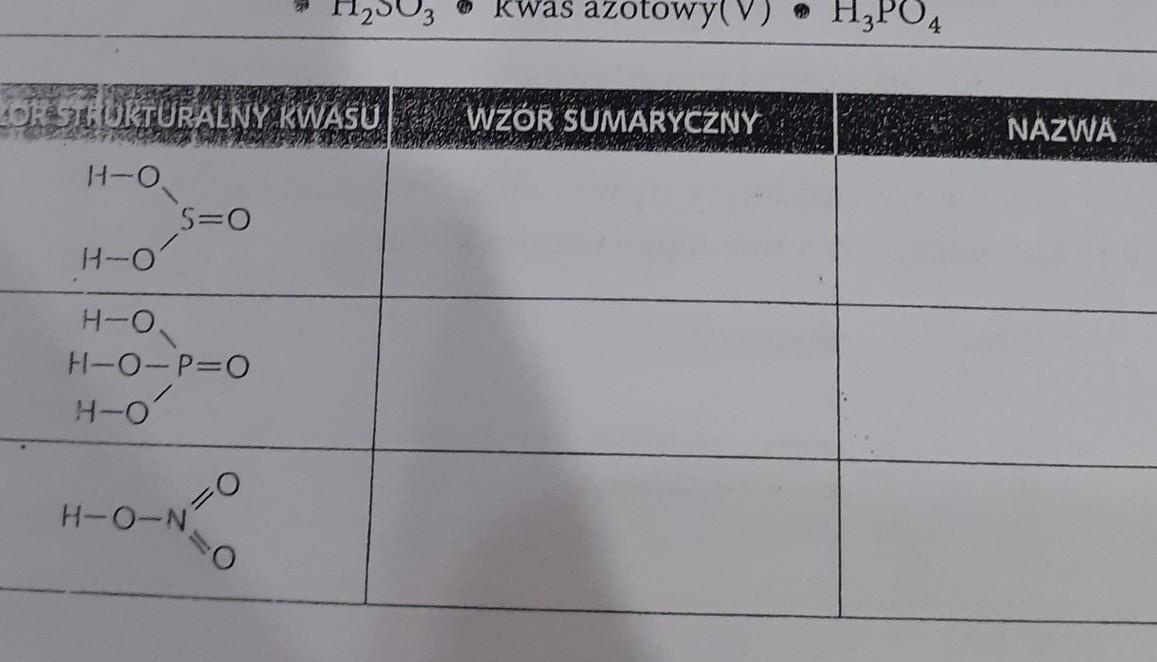
Przykład 1: H2SO4
Wzór sumaryczny H2SO4 to kwas siarkowy(VI). Liczba VI w nawiasie oznacza stopień utlenienia siarki.
Przykład 2: HNO3
Wzór sumaryczny HNO3 to kwas azotowy(V). Liczba V w nawiasie oznacza stopień utlenienia azotu.
Przykład 3: H3PO4
Wzór sumaryczny H3PO4 to kwas fosforowy(V). Liczba V w nawiasie oznacza stopień utlenienia fosforu.
Przykład 4: H2CO3
Wzór sumaryczny H2CO3 to kwas węglowy. W tym przypadku nie podajemy stopnia utlenienia w nazwie systematycznej, bo jest on powszechnie znany (IV).
Przykład 5: HClO4
Wzór sumaryczny HClO4 to kwas chlorowy(VII). Liczba VII w nawiasie oznacza stopień utlenienia chloru.
Kwasy o różnych stopniach utlenienia tego samego niemetalu
Niekiedy dany niemetal tworzy kwasy o różnych stopniach utlenienia. Wtedy używamy przedrostków i przyrostków, aby je odróżnić.
Przykład: Kwasy chloru
- HClO - kwas podchlorawy (chlor ma stopień utlenienia +I)
- HClO2 - kwas chlorawy (chlor ma stopień utlenienia +III)
- HClO3 - kwas chlorowy (chlor ma stopień utlenienia +V)
- HClO4 - kwas nadchlorowy (chlor ma stopień utlenienia +VII)
Podobnie postępujemy z kwasami innych niemetali, np. siarki.
Wzory sumaryczne a dysocjacja kwasów
Liczba atomów wodoru w cząsteczce kwasu wskazuje na to, ile jonów H+ może oddać kwas podczas dysocjacji. Na przykład:
- HCl → H+ + Cl- (kwas jednoprotonowy)
- H2SO4 → 2H+ + SO42- (kwas dwuprotonowy)
- H3PO4 → 3H+ + PO43- (kwas trójprotonowy)
Praktyczne zastosowania
Kwasy mają szerokie zastosowanie w przemyśle, laboratoriach i życiu codziennym.
Kwas siarkowy(VI) (H2SO4) jest wykorzystywany m.in. do produkcji nawozów, detergentów i włókien syntetycznych.
Kwas chlorowodorowy (HCl), znany również jako kwas solny, jest używany w przemyśle chemicznym i metalurgicznym. W rozcieńczonej formie występuje w żołądku, wspomagając trawienie.
Kwas octowy (CH3COOH), zawarty w occie, jest używany jako przyprawa i konserwant.
Kwas cytrynowy (C6H8O7) jest naturalnym składnikiem wielu owoców i jest stosowany jako dodatek do żywności i kosmetyków.
Podsumowanie
Rozpoznawanie i nazywanie kwasów na podstawie ich wzorów sumarycznych jest kluczową umiejętnością w chemii. Pamiętajmy o różnicy między kwasami beztlenowymi i tlenowymi oraz o zasadach tworzenia ich nazw.
Ćwiczenie z różnymi przykładami pomoże utrwalić wiedzę i ułatwić dalszą naukę chemii.
Warto zapamiętać, że właściwości kwasów zależą nie tylko od ich składu, ale także od ich stężenia i warunków reakcji.