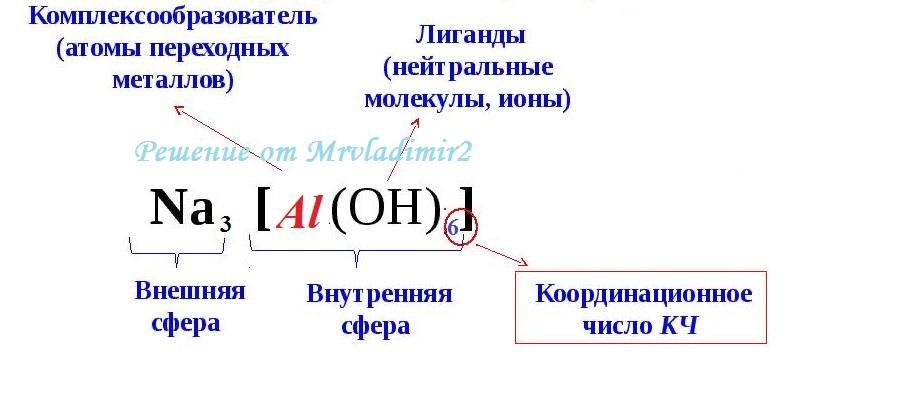
Zajmijmy się reakcją chemiczną pomiędzy wodorotlenkiem glinu sodu (Na3Al(OH)6) a kwasem solnym (HCl). Omówimy ją krok po kroku, aby zrozumieć, co się dzieje na poziomie molekularnym i jakie są produkty tej reakcji.
Co to są substraty?
Zanim przejdziemy do samej reakcji, zdefiniujmy substraty, czyli substancje wchodzące w reakcję. Pierwszym z nich jest wodorotlenek glinu sodu, o wzorze Na3Al(OH)6. Jest to związek kompleksowy, w którym jony sodu (Na+), jon glinu (Al3+) i grupy wodorotlenowe (OH-) tworzą określoną strukturę. Należy zauważyć, że glin jest skoordynowany z sześcioma grupami hydroksylowymi.
Drugim substratem jest kwas solny (HCl). Jest to mocny kwas, który w roztworze wodnym dysocjuje na jony wodorowe (H+) i jony chlorkowe (Cl-). Siła kwasu solnego polega na jego zdolności do oddawania protonów (H+) w reakcjach chemicznych.
Jak przebiega reakcja?
Reakcja pomiędzy Na3Al(OH)6 a HCl jest reakcją neutralizacji, w której kwas (HCl) reaguje z zasadą (wodorotlenkiem glinu sodu). Protony (H+) z kwasu solnego reagują z grupami wodorotlenowymi (OH-) obecnymi w wodorotlenku glinu sodu, tworząc wodę (H2O). Jednocześnie, jony sodu (Na+) i glinu (Al3+) łączą się z jonami chlorkowymi (Cl-), tworząc odpowiednie chlorki.
Równanie reakcji można zapisać następująco:
Na3Al(OH)6 + 6HCl → 3NaCl + AlCl3 + 6H2O
Zwróćmy uwagę na stechiometrię reakcji. Jeden mol wodorotlenku glinu sodu reaguje z sześcioma molami kwasu solnego. W wyniku reakcji powstają trzy mole chlorku sodu (NaCl), jeden mol chlorku glinu (AlCl3) i sześć moli wody (H2O).
Szczegółowy opis procesu
Proces można rozpatrywać jako serię reakcji. Grupy OH- z Na3Al(OH)6 są stopniowo protonowane przez H+ z HCl, co prowadzi do uwolnienia wody. Najpierw, proton atakuje jedną z grup OH-, tworząc cząsteczkę wody i zmieniając strukturę kompleksu glinu. Następnie, kolejne protony atakują pozostałe grupy OH-, aż do całkowitego zobojętnienia. Jony sodu (Na+) uwalniają się z kompleksu i łączą się z jonami chlorkowymi (Cl-), tworząc chlorek sodu (NaCl). Podobnie, jon glinu (Al3+) łączy się z jonami chlorkowymi (Cl-), tworząc chlorek glinu (AlCl3).
Produkty reakcji
Produktami reakcji są: chlorek sodu (NaCl), chlorek glinu (AlCl3) i woda (H2O).
- Chlorek sodu (NaCl), znany również jako sól kuchenna, jest związkiem jonowym, dobrze rozpuszczalnym w wodzie. Jest szeroko stosowany w przemyśle spożywczym, chemicznym i w życiu codziennym.
- Chlorek glinu (AlCl3) jest związkiem kowalencyjnym o charakterze jonowym, który w roztworach wodnych ulega hydrolizie, tworząc kwasne środowisko. Stosowany jest jako katalizator w reakcjach chemicznych, w przemyśle kosmetycznym (jako składnik antyperspirantów) i w procesach uzdatniania wody.
- Woda (H2O) jest rozpuszczalnikiem, który rozprasza produkty reakcji w roztworze.
Zastosowania praktyczne
Reakcja pomiędzy wodorotlenkiem glinu sodu a kwasem solnym, choć może wydawać się abstrakcyjna, ma potencjalne zastosowania w różnych dziedzinach. Na przykład, w chemii analitycznej można ją wykorzystać do identyfikacji i oznaczania ilościowego wodorotlenku glinu sodu. Kontrolując parametry reakcji (np. stężenie kwasu solnego, temperaturę) można precyzyjnie określić zawartość wodorotlenku glinu sodu w danej próbce.
Ponadto, znajomość tej reakcji jest ważna w kontekście bezpieczeństwa. Należy pamiętać, że mieszanie mocnych kwasów z zasadami może prowadzić do gwałtownego wydzielania ciepła i potencjalnego rozpryskiwania substancji. Dlatego też, podczas wykonywania takich reakcji w laboratorium, należy zachować szczególną ostrożność i stosować odpowiednie środki ochrony osobistej (np. okulary ochronne, rękawice).
Reakcja neutralizacji, której przykładem jest reakcja wodorotlenku glinu sodu z kwasem solnym, jest jednym z fundamentalnych typów reakcji chemicznych. Zrozumienie jej mechanizmu i konsekwencji jest kluczowe dla dalszego zgłębiania wiedzy z zakresu chemii.
Podsumowując, reakcja Na3Al(OH)6 + 6HCl → 3NaCl + AlCl3 + 6H2O jest reakcją neutralizacji, w której wodorotlenek glinu sodu reaguje z kwasem solnym, tworząc chlorek sodu, chlorek glinu i wodę. Zrozumienie tej reakcji wymaga znajomości podstawowych pojęć z zakresu chemii, takich jak kwasy, zasady, stechiometria i mechanizmy reakcji. Wiedza ta jest nie tylko teoretyczna, ale również ma zastosowanie w praktyce, na przykład w chemii analitycznej i w aspekcie bezpieczeństwa pracy w laboratorium.