Hej! Przygotowujesz się do egzaminu z chemii? Świetnie! Skupmy się na identyfikowaniu pierwiastków na podstawie modeli atomów.
Podstawy Budowy Atomu
Zacznijmy od przypomnienia sobie podstaw. Atom składa się z jądra i elektronów.
W jądrze znajdują się protony (ładunek dodatni) i neutrony (ładunek obojętny).
Elektrony (ładunek ujemny) krążą wokół jądra na różnych powłokach elektronowych.
Liczba Atomowa (Z)
Liczba atomowa (Z) to liczba protonów w jądrze atomu. To ona identyfikuje pierwiastek.
Na przykład, jeśli atom ma 6 protonów, to jest to węgiel (C).
Liczba atomowa jest najważniejsza przy identyfikacji pierwiastka!
Liczba Masowa (A)
Liczba masowa (A) to suma protonów i neutronów w jądrze atomu.
A = liczba protonów + liczba neutronów.
Izotopy danego pierwiastka mają różną liczbę neutronów, a więc różną liczbę masową.
Modele Atomów i Identyfikacja Pierwiastków
Teraz przejdźmy do praktyki! Jak z modelu atomu odczytać nazwę i symbol pierwiastka?
Krok 1: Policz Protony
Najważniejszy krok! Policz, ile protonów znajduje się w jądrze atomu. Pamiętaj, że liczba protonów = liczba atomowa (Z).
Modele atomów często wizualizują protony jako kulki z plusem (+).
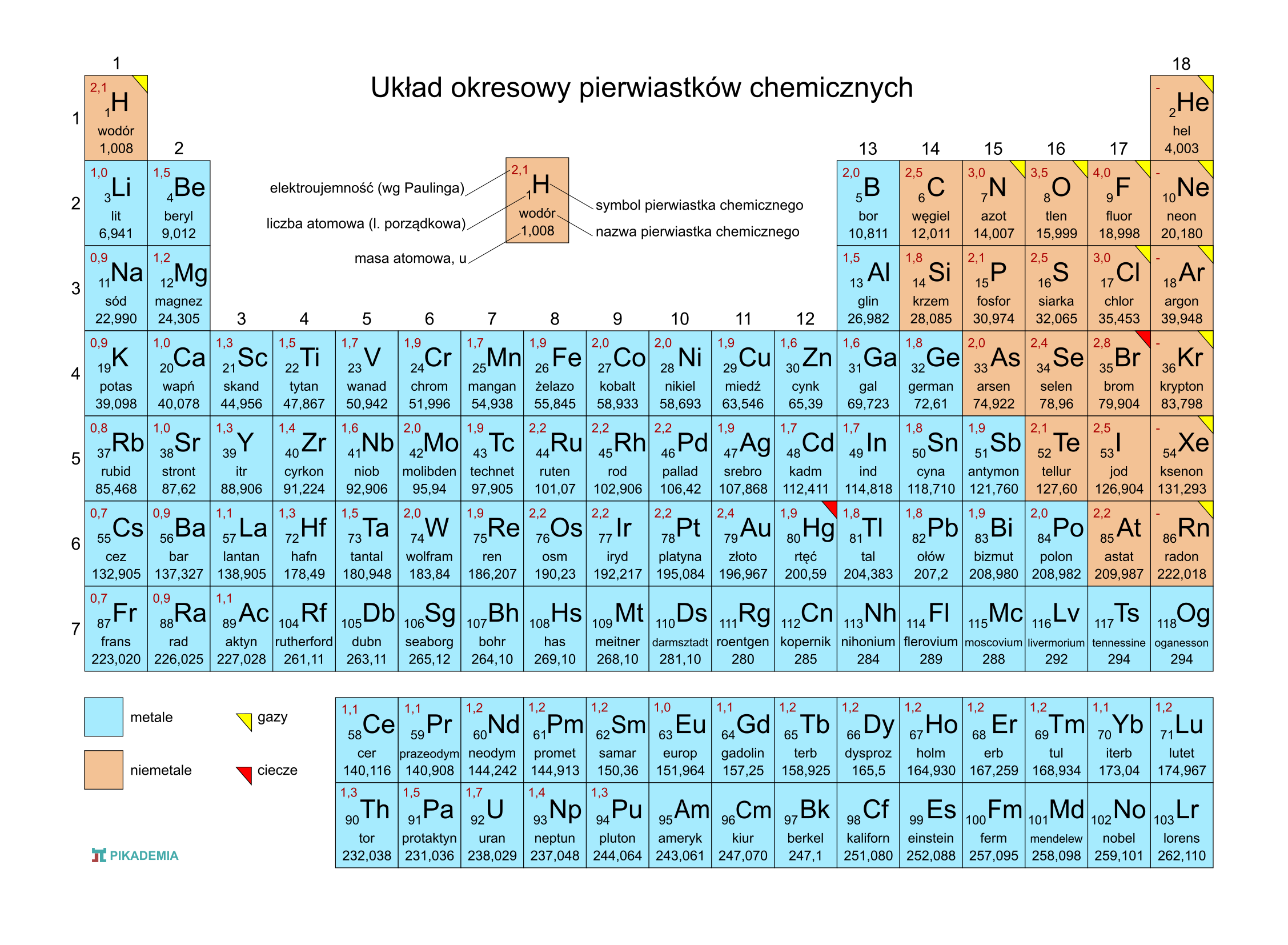
Krok 2: Znajdź Liczbę Atomową w Układzie Okresowym
Mając liczbę atomową, znajdź ją w układzie okresowym pierwiastków.
Układ okresowy to Twoja najlepsza broń! Każdy pierwiastek ma tam swoje miejsce.
Krok 3: Odczytaj Symbol i Nazwę Pierwiastka
Obok liczby atomowej znajdziesz symbol pierwiastka (np. H dla wodoru, O dla tlenu) oraz jego nazwę.
Symbol pierwiastka to skrót, zwykle jedna lub dwie litery.
Przykład
Model atomu pokazuje, że w jądrze są 8 protony.
Z = 8. Szukamy 8 w układzie okresowym.
Widzimy, że pierwiastek o liczbie atomowej 8 to tlen (O).
Przykładowe Zadania
Sprawdźmy, czy już to rozumiesz!
Zadanie 1
Model atomu ma 1 proton.
Rozwiązanie: Z = 1. To wodór (H).
Zadanie 2
Model atomu ma 11 protonów.
Rozwiązanie: Z = 11. To sód (Na).
Zadanie 3
Model atomu ma 17 protonów.
Rozwiązanie: Z = 17. To chlor (Cl).
Pamiętaj o Pułapkach!
Uważaj na izotopy! Choć mają różną liczbę neutronów (a więc różną liczbę masową), to *liczba protonów* jest taka sama i identyfikuje pierwiastek.
Nie pomyl *liczby masowej* z liczbą atomową!
Czasami modele atomów mogą przedstawiać jony. Pamiętaj, że *liczba protonów* się nie zmienia! Jon ma inną liczbę elektronów niż atom neutralny.
Układ Okresowy – Twój Przyjaciel
Zapamiętaj układ okresowy! Znajomość położenia najważniejszych pierwiastków bardzo ułatwia identyfikację.
Skup się na pierwiastkach z pierwszych trzech okresów. One pojawiają się najczęściej.
Zwróć uwagę na grupy, np. metale alkaliczne (grupa 1), metale ziem alkalicznych (grupa 2), halogeny (grupa 17), gazy szlachetne (grupa 18).
Podsumowanie
Kluczowe kroki do identyfikacji pierwiastka na podstawie modelu atomu:
- Policz protony.
- Znajdź liczbę atomową (Z) w układzie okresowym.
- Odczytaj symbol i nazwę pierwiastka.
Pamiętaj, ćwiczenie czyni mistrza! Im więcej przykładów rozwiążesz, tym łatwiej będzie Ci identyfikować pierwiastki.
Powodzenia na egzaminie! Wierzę w Ciebie!