Cząsteczki, z których zbudowany jest otaczający nas świat, utrzymują się razem dzięki różnym rodzajom wiązań chemicznych. Jednym z najważniejszych i powszechnych typów wiązań jest wiązanie kowalencyjne.
Czym Jest Wiązanie Kowalencyjne?
Wiązanie kowalencyjne powstaje, gdy atomy dzielą się elektronami walencyjnymi (elektronami znajdującymi się na zewnętrznej powłoce). Dzielenie się elektronami pozwala atomom osiągnąć bardziej stabilną konfigurację elektronową, zazwyczaj odpowiadającą konfiguracji gazu szlachetnego. Oznacza to, że chcą mieć 8 elektronów na swojej zewnętrznej powłoce (oktet) lub 2 elektrony (duet) w przypadku atomów takich jak wodór. Wiązanie kowalencyjne jest szczególnie charakterystyczne dla niemetali łączących się ze sobą.
Wyobraź sobie dwa atomy wodoru (H). Każdy z nich ma tylko jeden elektron. Aby osiągnąć stabilną konfigurację (duet), potrzebują jeszcze jednego elektronu. Zamiast tracić lub zyskiwać elektrony (jak to ma miejsce w wiązaniach jonowych), dwa atomy wodoru dzielą się swoimi elektronami. W ten sposób, każdy atom wodoru "czuje", że ma dwa elektrony krążące wokół jądra, co daje mu stabilność. Tak właśnie powstaje cząsteczka wodoru (H2).
Rodzaje Wiązań Kowalencyjnych
Wiązania kowalencyjne dzielimy na kilka rodzajów, biorąc pod uwagę liczbę par elektronów, które atomy ze sobą dzielą. Możemy wyróżnić:
- Wiązanie pojedyncze: Atomy dzielą się jedną parą elektronów. Na przykład, wiązanie w cząsteczce wodoru (H-H) lub w cząsteczce chloru (Cl-Cl).
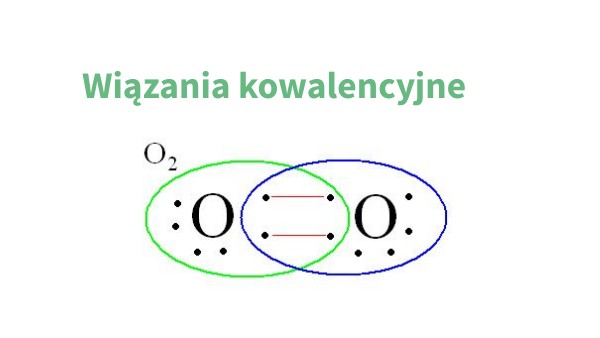
- Wiązanie podwójne: Atomy dzielą się dwiema parami elektronów. Na przykład, wiązanie w cząsteczce tlenu (O=O).
- Wiązanie potrójne: Atomy dzielą się trzema parami elektronów. Na przykład, wiązanie w cząsteczce azotu (N≡N).
Im więcej par elektronów jest dzielonych, tym mocniejsze i krótsze jest wiązanie. Czyli wiązanie potrójne jest mocniejsze i krótsze niż wiązanie podwójne, które z kolei jest mocniejsze i krótsze niż wiązanie pojedyncze.
Wiązanie Kowalencyjne Spolaryzowane i Niespolaryzowane
Równie ważny jest podział wiązań kowalencyjnych ze względu na elektroujemność atomów tworzących wiązanie. Elektroujemność to zdolność atomu do przyciągania elektronów w wiązaniu chemicznym.
Wiązanie kowalencyjne niespolaryzowane (inaczej apolarne) powstaje, gdy atomy mają bardzo zbliżoną elektroujemność. Wtedy elektrony są dzielone równomiernie między atomy. Klasycznym przykładem jest wiązanie w cząsteczkach takich jak H2, Cl2, czy O2. Ponieważ atomy są tego samego pierwiastka, mają identyczną elektroujemność i żaden atom nie przyciąga elektronów silniej od drugiego.
Wiązanie kowalencyjne spolaryzowane (polarne) powstaje, gdy atomy mają różne elektroujemności. Atom o większej elektroujemności przyciąga elektrony silniej, tworząc częściowy ładunek ujemny (δ-) na sobie i częściowy ładunek dodatni (δ+) na drugim atomie. Dobrym przykładem jest woda (H2O). Tlen jest bardziej elektroujemny niż wodór, dlatego elektrony w wiązaniach O-H są przesunięte w kierunku tlenu. Powoduje to, że tlen ma częściowy ładunek ujemny, a wodory mają częściowe ładunki dodatnie. To sprawia, że cząsteczka wody jest dipolem.
Właściwości Związków Kowalencyjnych
Związki kowalencyjne generalnie charakteryzują się niższymi temperaturami topnienia i wrzenia niż związki jonowe. Dzieje się tak, ponieważ siły międzycząsteczkowe (siły van der Waalsa, wiązania wodorowe) utrzymujące je razem są słabsze niż silne oddziaływania elektrostatyczne między jonami w związkach jonowych. Ważne jest, że właściwości zależą też od polarności wiązania w cząsteczce i kształtu cząsteczki.
Wiele związków kowalencyjnych jest słabo rozpuszczalnych w wodzie, szczególnie te, które są niespolaryzowane. Związki polarne, takie jak alkohol etylowy (C2H5OH), mogą dobrze rozpuszczać się w wodzie, ponieważ tworzą wiązania wodorowe z cząsteczkami wody. Rozpuszczalność zależy od interakcji między cząsteczkami związku a cząsteczkami rozpuszczalnika.
Zazwyczaj związki kowalencyjne nie przewodzą prądu elektrycznego, ponieważ elektrony są związane w wiązaniach i nie mogą swobodnie się przemieszczać. Wyjątkiem są niektóre substancje, jak grafit (odmiana alotropowa węgla), w których elektrony mogą się delokalizować i przewodzić prąd.
Przykłady i Zastosowania
Wiązania kowalencyjne występują w ogromnej liczbie związków organicznych i nieorganicznych. Przykłady obejmują: metan (CH4), dwutlenek węgla (CO2), amoniak (NH3), glukozę (C6H12O6) i wiele innych.
Zastosowania związków kowalencyjnych są bardzo szerokie i obejmują: tworzywa sztuczne (polietylen, polipropylen), leki, paliwa (metan, propan, butan), rozpuszczalniki (aceton, etanol) oraz wiele innych.
Zrozumienie natury wiązania kowalencyjnego jest kluczowe do zrozumienia struktury i właściwości materii, od najprostszych cząsteczek po złożone biomolekuły.