Hej! Zastanawialiście się kiedyś, dlaczego sól kuchenna rozpuszcza się w wodzie? Albo dlaczego woda z kranu przewodzi prąd (choć czysta woda go nie przewodzi)? Odpowiedź leży w fascynującym zjawisku zwanym dysocjacją elektrolityczną. Przygotujcie się na podróż do świata jonów i roztworów!
Czym w ogóle są elektrolity?
Zacznijmy od podstaw. Elektrolity to substancje, które po rozpuszczeniu w wodzie lub stopieniu przewodzą prąd elektryczny. Brzmi skomplikowanie? Spokojnie! Pomyślcie o soli kuchennej (chlorku sodu – NaCl), kwasie octowym (occie) czy wodorotlenku sodu (krecie do udrażniania rur). To wszystko są elektrolity. Cechą wspólną tych substancji jest to, że w odpowiednich warunkach rozpadają się na jony.
Jony to atomy lub grupy atomów, które posiadają ładunek elektryczny. Mogą być dodatnie (kationy) lub ujemne (aniony). Atomy stają się jonami, gdy tracą lub zyskują elektrony. Na przykład, atom sodu (Na) może stracić jeden elektron, stając się kationem sodu (Na+). Z kolei atom chloru (Cl) może zyskać jeden elektron, stając się anionem chlorkowym (Cl-).
Dysocjacja – co to takiego?
Dysocjacja elektrolityczna to proces rozpadu elektrolitu na jony pod wpływem rozpuszczalnika (najczęściej wody). Inaczej mówiąc, to rozdzielenie się związku chemicznego na jony, które mogą swobodnie poruszać się w roztworze. To właśnie te jony, posiadające ładunek elektryczny, umożliwiają przewodzenie prądu w roztworze.
Wyobraźcie sobie, że wrzucacie sól kuchenną (NaCl) do wody. Cząsteczki wody (H2O), które są polarne (mają część dodatnią i ujemną), zaczynają "atakować" kryształ soli. Przyciągają one jony sodu (Na+) i jony chlorkowe (Cl-), osłabiając wiązania jonowe, które trzymają je razem w krysztale.
Ostatecznie, woda "wyrywa" jony sodu i chlorkowe z kryształu, otaczając je swoimi cząsteczkami. Ten proces nazywamy solwatacją (jeśli rozpuszczalnikiem jest woda, mówimy o hydratacji). Jony sodu i chlorkowe, otoczone przez cząsteczki wody, mogą swobodnie poruszać się w roztworze, przenosząc ładunek elektryczny. Dzięki temu roztwór soli przewodzi prąd.
Jak to wygląda w praktyce?
Równanie dysocjacji chlorku sodu (NaCl) wygląda następująco:
NaCl → Na+ + Cl-
Oznacza to, że jedna cząsteczka chlorku sodu rozpada się na jeden jon sodu (Na+) i jeden jon chlorkowy (Cl-).
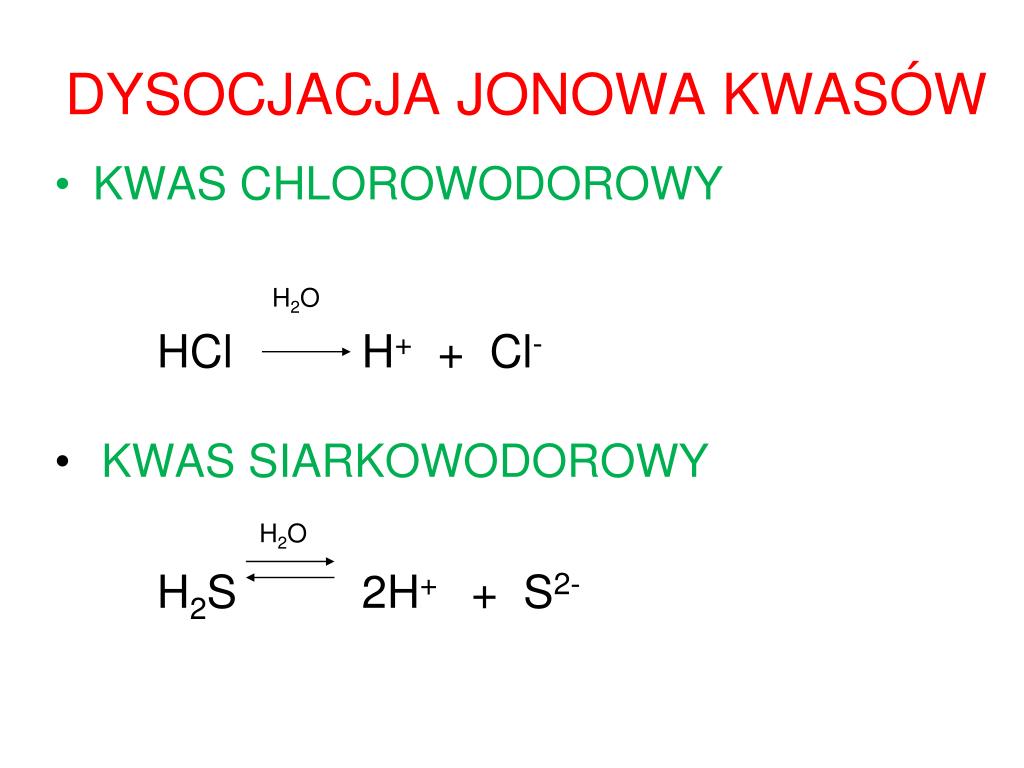
Inny przykład: kwas solny (HCl), który znajduje się w żołądku i pomaga w trawieniu, również dysocjuje w wodzie:
HCl → H+ + Cl-
Tutaj kwas solny rozpada się na jon wodorowy (H+), który jest odpowiedzialny za kwasowość, i jon chlorkowy (Cl-).
Elektrolity mocne i słabe
Nie wszystkie elektrolity dysocjują w ten sam sposób. Dzielimy je na elektrolity mocne i elektrolity słabe. Elektrolity mocne dysocjują w wodzie prawie całkowicie. Oznacza to, że prawie wszystkie cząsteczki elektrolitu rozpadają się na jony. Przykładami elektrolitów mocnych są: chlorek sodu (NaCl), kwas solny (HCl), wodorotlenek sodu (NaOH).
Elektrolity słabe dysocjują tylko w niewielkim stopniu. Oznacza to, że w roztworze znajduje się równowaga między niezdysocjowanymi cząsteczkami elektrolitu a jonami. Przykładami elektrolitów słabych są: kwas octowy (CH3COOH), amoniak (NH3) i woda (H2O). Dysocjację słabego elektrolitu zapisujemy za pomocą strzałki w obie strony, aby pokazać stan równowagi.
Równanie dysocjacji kwasu octowego wygląda następująco:
CH3COOH ⇌ CH3COO- + H+
Widzimy, że strzałka jest w obie strony, co oznacza, że proces dysocjacji zachodzi w obie strony, a w roztworze obecne są zarówno cząsteczki kwasu octowego, jak i jony octanowe (CH3COO-) i jony wodorowe (H+).
Stopień dysocjacji
Aby opisać, w jakim stopniu dany elektrolit dysocjuje w roztworze, używamy pojęcia stopnia dysocjacji (α). Jest to stosunek liczby cząsteczek, które uległy dysocjacji, do całkowitej liczby cząsteczek elektrolitu wprowadzonych do roztworu.
α = (liczba cząsteczek zdysocjowanych) / (liczba cząsteczek wprowadzonych)
Stopień dysocjacji może przyjmować wartości od 0 do 1 (lub od 0% do 100%). Dla elektrolitów mocnych α jest bliskie 1, a dla elektrolitów słabych α jest znacznie mniejsze od 1.
Zastosowania dysocjacji elektrolitycznej
Dysocjacja elektrolityczna ma ogromne znaczenie w wielu dziedzinach nauki i życia codziennego. Oto kilka przykładów:
- Chemia: Dysocjacja elektrolityczna jest podstawą wielu reakcji chemicznych, zwłaszcza reakcji zachodzących w roztworach wodnych. Umożliwia zrozumienie mechanizmów reakcji i przewidywanie ich przebiegu.
- Biologia: Jony odgrywają kluczową rolę w procesach biologicznych, takich jak przewodzenie impulsów nerwowych, skurcz mięśni i utrzymanie równowagi kwasowo-zasadowej w organizmie.
- Medycyna: Roztwory elektrolitowe są stosowane w leczeniu odwodnienia, zaburzeń elektrolitowych i jako nośniki leków.
- Przemysł: Dysocjacja elektrolityczna jest wykorzystywana w wielu procesach przemysłowych, takich jak elektroliza (np. produkcja chloru i wodorotlenku sodu), galwanotechnika (pokrywanie metali innymi metalami) i produkcja baterii.
Mam nadzieję, że teraz dysocjacja elektrolityczna nie brzmi już tak strasznie. Pamiętajcie, że kluczem do zrozumienia tego zjawiska jest pojęcie jonów i ich roli w przewodzeniu prądu w roztworach. Powodzenia w dalszej nauce chemii!