Cześć! Porozmawiamy dzisiaj o wodorotlenkach i o tym, jak je otrzymywać. To naprawdę ciekawy temat, a wcale nie taki trudny, jak mogłoby się wydawać. Spróbujemy to wszystko rozłożyć na czynniki pierwsze, żebyś zrozumiał wszystko krok po kroku.
Co to jest wodorotlenek?
Zacznijmy od podstaw. Wodorotlenki to związki chemiczne, które zawierają kation metalu i anion wodorotlenkowy (OH-). Anion wodorotlenkowy to po prostu atom tlenu połączony z atomem wodoru, który ma ładunek ujemny. Wzór ogólny wodorotlenku to M(OH)n, gdzie M to metal, a n to jego wartościowość.
Pomyśl o tym jak o klockach LEGO. Masz "metalowy klocek" (M) i "wodorotlenkowy klocek" (OH). Łączysz je razem, żeby powstał wodorotlenek. Liczba "wodorotlenkowych klocków", które możesz połączyć zależy od tego, jaki masz "metalowy klocek".
Przykłady wodorotlenków
Znasz pewnie kilka wodorotlenków z życia codziennego. Na przykład wodorotlenek sodu (NaOH), znany też jako soda kaustyczna. Używa się go do udrożniania rur. Kolejny przykład to wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone. Wykorzystuje się go w budownictwie.
Metody otrzymywania wodorotlenków
Teraz przejdźmy do sedna, czyli jak otrzymujemy te związki. Istnieje kilka głównych metod. Omówimy każdą z nich po kolei, żeby wszystko było jasne. Zobaczymy, że reakcje chemiczne mogą być naprawdę proste i logiczne.
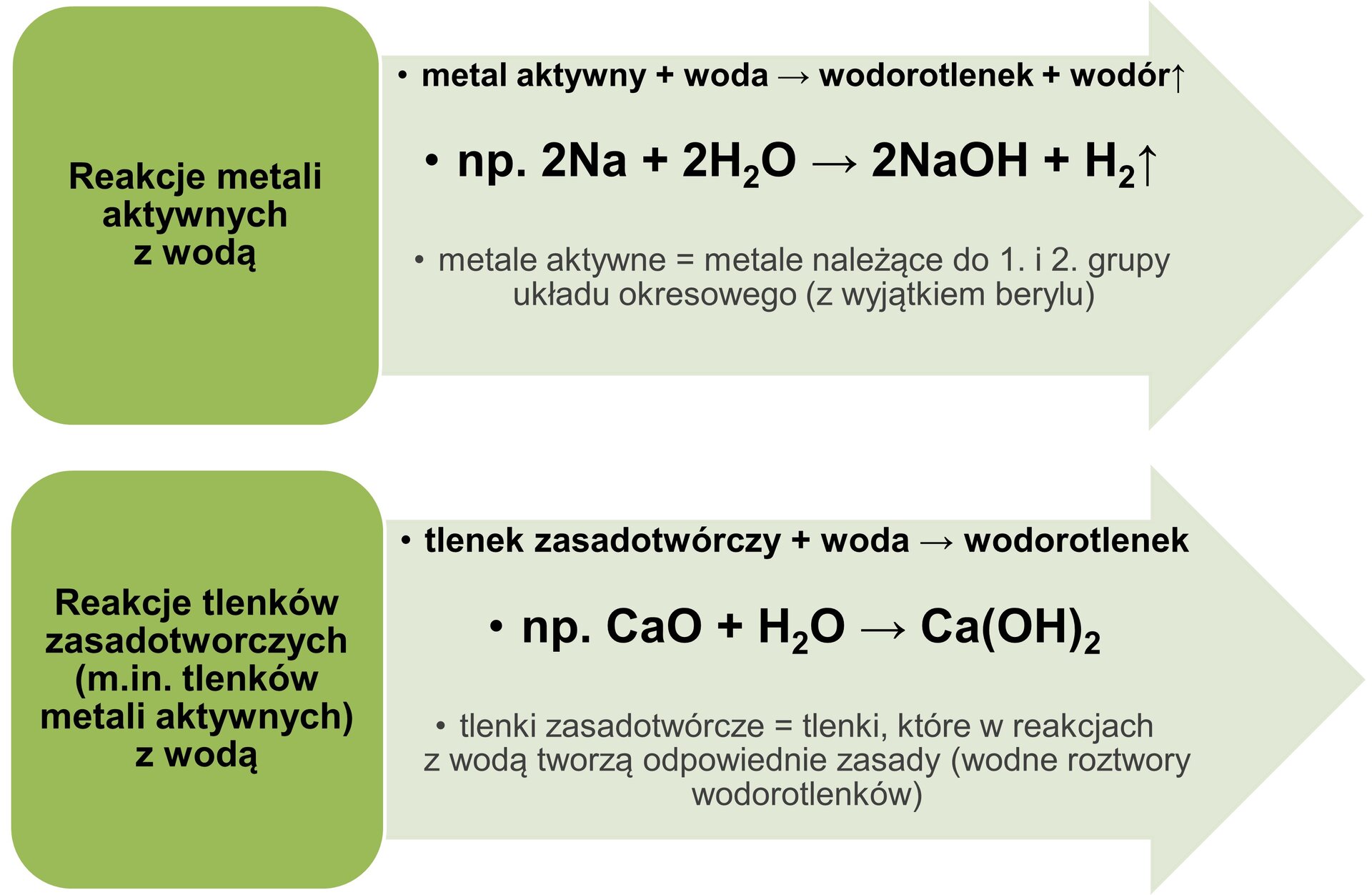
Reakcja aktywnego metalu z wodą
Pierwsza metoda to reakcja aktywnego metalu z wodą. Przez aktywny metal rozumiemy metal z grupy 1 i 2 układu okresowego. Te metale bardzo chętnie reagują z wodą, tworząc wodorotlenek i wodór.
Weźmy na przykład sód (Na). Kiedy wrzucisz sód do wody, zajdzie bardzo gwałtowna reakcja. Powstanie wodorotlenek sodu (NaOH) i wodór (H2). Równanie reakcji wygląda tak: 2Na + 2H2O → 2NaOH + H2. To ważne, żeby pamiętać, że ta reakcja jest egzotermiczna, czyli wydziela ciepło.
Podobnie reaguje potas (K). Reakcja jest jeszcze bardziej gwałtowna niż w przypadku sodu. Powstaje wodorotlenek potasu (KOH) i wodór (H2). Równanie reakcji: 2K + 2H2O → 2KOH + H2. Pamiętaj, że prace laboratoryjne z metalami aktywnymi wymagają ostrożności i odpowiedniego sprzętu ochronnego!
Reakcja tlenku metalu z wodą
Druga metoda to reakcja tlenku metalu z wodą. Tlenek metalu to związek metalu z tlenem (np. Na2O, CaO). Ta metoda działa dobrze z tlenkami metali z grupy 1 i 2, czyli tych samych, co poprzednio.
Weźmy na przykład tlenek wapnia (CaO), czyli wapno palone. Kiedy dodasz go do wody, zajdzie reakcja i powstanie wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone. Równanie reakcji: CaO + H2O → Ca(OH)2. Ta reakcja również wydziela ciepło.
Innym przykładem jest tlenek sodu (Na2O). Reaguje z wodą tworząc wodorotlenek sodu (NaOH). Równanie reakcji: Na2O + H2O → 2NaOH. Pamiętaj, że tlenki metali mogą być drażniące, więc należy zachować ostrożność podczas pracy z nimi.
Reakcja soli z zasadą
Trzecia metoda to reakcja soli z zasadą. Ta metoda jest używana, gdy chcemy otrzymać wodorotlenek metalu, który jest nierozpuszczalny w wodzie. Zasada to po prostu rozpuszczalny w wodzie wodorotlenek.
Weźmy na przykład chlorek żelaza(III) (FeCl3) i wodorotlenek sodu (NaOH). Kiedy zmieszasz te dwa roztwory, powstanie wodorotlenek żelaza(III) (Fe(OH)3), który jest nierozpuszczalnym osadem. Równanie reakcji: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl. Strzałka w dół (↓) oznacza, że związek strąca się z roztworu.
Inny przykład to siarczan miedzi(II) (CuSO4) i wodorotlenek potasu (KOH). Reakcja prowadzi do powstania wodorotlenku miedzi(II) (Cu(OH)2), który również jest nierozpuszczalnym osadem. Równanie reakcji: CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4. Obserwacja osadu jest ważnym dowodem na zajście reakcji.
Elektroliza roztworów soli
Czwarta metoda to elektroliza roztworów soli. Elektroliza to proces rozkładu substancji za pomocą prądu elektrycznego. W tym przypadku, używamy roztworu soli, a na elektrodach zachodzą reakcje, które prowadzą do powstania wodorotlenku.
Weźmy na przykład elektrolizę roztworu chlorku sodu (NaCl), czyli solanki. Na katodzie (elektrodzie ujemnej) redukują się jony wodorowe z wody, tworząc wodór (H2) i jony wodorotlenkowe (OH-). W okolicy katody gromadzi się więc wodorotlenek sodu (NaOH). Równocześnie, na anodzie (elektrodzie dodatniej) utleniają się jony chlorkowe, tworząc chlor (Cl2).
Proces elektrolizy jest bardziej skomplikowany, ale pozwala na otrzymywanie czystych wodorotlenków. Pamiętaj, że elektroliza wymaga specjalistycznego sprzętu i wiedzy, aby przeprowadzić ją bezpiecznie.
Podsumowanie
Otrzymywanie wodorotlenków to fascynujący proces, który można realizować na wiele sposobów. Mówiliśmy o reakcji aktywnego metalu z wodą, tlenku metalu z wodą, soli z zasadą i elektrolizie roztworów soli. Każda z tych metod ma swoje zastosowania i wymaga specyficznych warunków.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć, czym są wodorotlenki i jak je otrzymywać. Jeśli masz jakieś pytania, śmiało pytaj. Chemia to naprawdę ciekawa dziedzina wiedzy!