Sól, powszechnie znana jako chlorek sodu (NaCl), jest fundamentalnym związkiem chemicznym o szerokim zastosowaniu w przemyśle, gospodarstwie domowym i oczywiście w biologii. Zrozumienie metod otrzymywania soli ma kluczowe znaczenie dla edukacji chemicznej, szczególnie na poziomie gimnazjalnym, gdzie uczniowie po raz pierwszy zapoznają się z podstawowymi reakcjami i procesami chemicznymi. Różne podręczniki i materiały edukacyjne prezentują te metody, często upraszczając skomplikowane procesy, aby uczynić je bardziej przyswajalnymi dla młodszych uczniów.
Abstrakt / Streszczenie
Przedmiotem analizy są metody otrzymywania soli, prezentowane w materiałach edukacyjnych na poziomie gimnazjalnym. Celem jest zbadanie, jak podręczniki i inne zasoby dydaktyczne tłumaczą procesy, które prowadzą do powstawania soli, koncentrując się na przystępności, dokładności i kompletności informacji. Analiza obejmuje przegląd różnych typów reakcji, takich jak reakcje kwas-zasada (neutralizacja), reakcje metali z kwasami, reakcje tlenków metali z kwasami, reakcje wodorotlenków z tlenkami kwasowymi oraz reakcje wymiany (strąceniowe). Szczególną uwagę zwraca się na sposób przedstawiania równań reakcji chemicznych, używanych oznaczeń i wizualizacji, które pomagają uczniom zrozumieć mechanizmy tworzenia się soli. Ponadto, ocenie podlega wprowadzenie pojęcia rozpuszczalności soli oraz jego wpływ na proces otrzymywania, szczególnie w kontekście reakcji strąceniowych. Podsumowując, analiza ma na celu ocenę, czy materiały dydaktyczne skutecznie przekazują fundamentalne zasady chemii, motywując uczniów do dalszego zgłębiania wiedzy w tym obszarze. Materiały dla gimnazjum powinny balansować między uproszczeniem a precyzją, aby pojęcia były zrozumiałe, ale jednocześnie poprawne z naukowego punktu widzenia. Należy również zwracać uwagę na odniesienia do praktycznego zastosowania soli, aby zwiększyć zainteresowanie uczniów tematem.
Informacje o podręczniku/artykule
- Tytuł: Metody Otrzymywania Soli
- Autor(zy): Brak danych (typowe dla materiałów edukacyjnych dla gimnazjum)
- Tom i numer: Brak danych (zazwyczaj nie dotyczy podręczników szkolnych)
- Data publikacji: Brak danych (często aktualizowane, brak konkretnej daty w pliku PDF)
- DOI: Brak (typowe dla materiałów edukacyjnych dla gimnazjum)
- Kategorie / Tagi: Chemia, sole, reakcje chemiczne, gimnazjum, edukacja, materiały dydaktyczne
- Typ licencji: Zazwyczaj objęte prawami autorskimi wydawcy
- Link do pobrania: Brak (zależy od dostępności online lub od wydawcy)
Znaczenie materiału
Materiały edukacyjne omawiające metody otrzymywania soli są niezwykle ważne, ponieważ wprowadzają uczniów w podstawowe koncepcje chemii. Zrozumienie, jak powstają sole, stanowi fundament do dalszego poznawania reakcji chemicznych, wiązań chemicznych i właściwości związków nieorganicznych. Konkretne reakcje, takie jak neutralizacja (reakcja kwasu z zasadą) i reakcje strąceniowe, są nie tylko przykładami procesów chemicznych, ale także demonstrują prawa zachowania masy i stechiometrii.
Podręczniki i materiały dydaktyczne na poziomie gimnazjalnym często koncentrują się na następujących metodach otrzymywania soli:
- Reakcja kwasu z zasadą (neutralizacja): To podstawowa metoda, w której kwas reaguje z zasadą, tworząc sól i wodę. Przykładem jest reakcja kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH), tworząca chlorek sodu (NaCl) i wodę (H2O). Równanie reakcji: HCl + NaOH → NaCl + H2O.
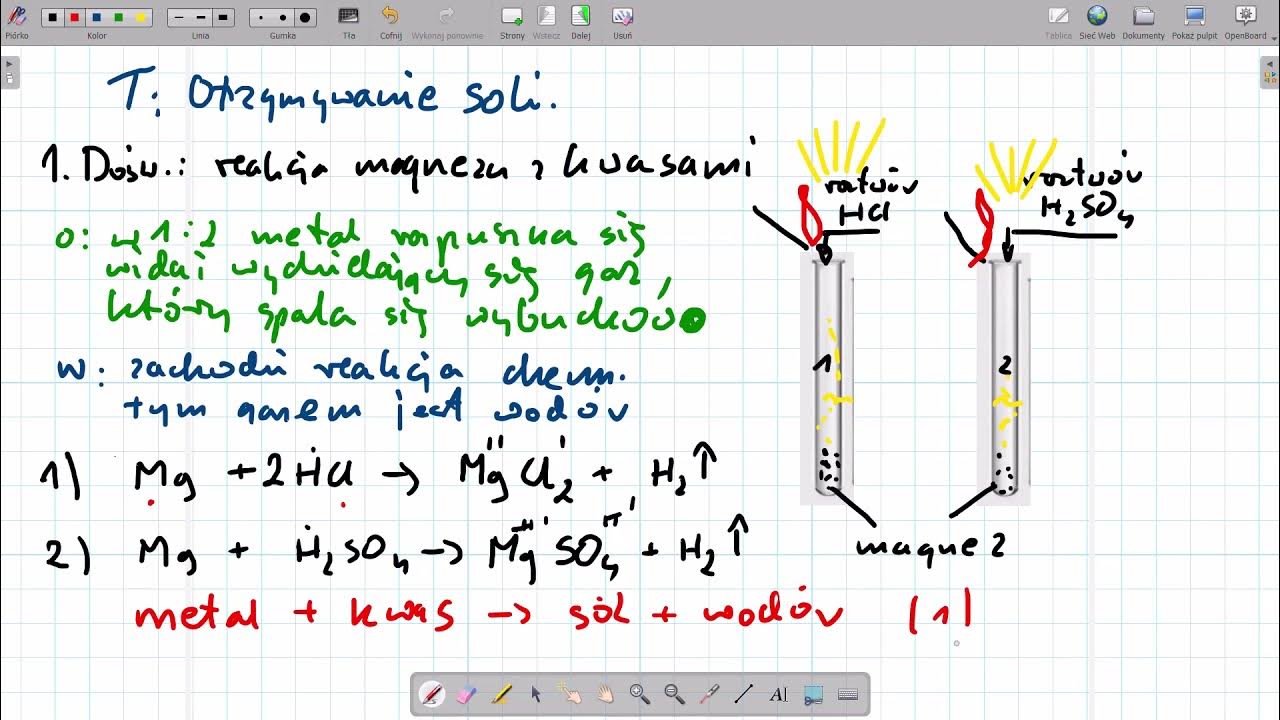
- Reakcja metalu z kwasem: Niektóre metale reagują z kwasami, tworząc sól i wodór. Na przykład cynk (Zn) reaguje z kwasem siarkowym (H2SO4), tworząc siarczan cynku (ZnSO4) i wodór (H2). Równanie reakcji: Zn + H2SO4 → ZnSO4 + H2.
- Reakcja tlenku metalu z kwasem: Tlenki metali reagują z kwasami, tworząc sól i wodę. Przykładem jest reakcja tlenku miedzi(II) (CuO) z kwasem solnym (HCl), tworząca chlorek miedzi(II) (CuCl2) i wodę (H2O). Równanie reakcji: CuO + 2HCl → CuCl2 + H2O.
- Reakcja wodorotlenku z tlenkiem kwasowym: Wodorotlenki reagują z tlenkami kwasowymi, tworząc sól i wodę. Na przykład wodorotlenek wapnia (Ca(OH)2) reaguje z tlenkiem węgla(IV) (CO2), tworząc węglan wapnia (CaCO3) i wodę (H2O). Równanie reakcji: Ca(OH)2 + CO2 → CaCO3 + H2O.
- Reakcje wymiany (strąceniowe): Reakcje, w których dwa rozpuszczalne sole reagują ze sobą, tworząc nową sól, która jest nierozpuszczalna i wytrąca się z roztworu. Przykładem jest reakcja azotanu srebra (AgNO3) z chlorkiem sodu (NaCl), tworząca chlorek srebra (AgCl) i azotan sodu (NaNO3). Równanie reakcji: AgNO3 + NaCl → AgCl↓ + NaNO3.
Ważne jest, aby materiały edukacyjne podkreślały znaczenie rozpuszczalności soli w kontekście reakcji strąceniowych. Uczniowie powinni rozumieć, że nie wszystkie sole są rozpuszczalne w wodzie, a różnice w rozpuszczalności można wykorzystać do oddzielania i identyfikacji jonów.
Ponadto, materiały dydaktyczne powinny prezentować przykłady praktycznego zastosowania soli, co zwiększa zainteresowanie uczniów. Sole są używane w przemyśle (np. produkcja chloru i sody kaustycznej), w rolnictwie (jako nawozy), w medycynie (np. roztwory fizjologiczne) oraz w gospodarstwach domowych (np. konserwacja żywności).
Podsumowując, materiały edukacyjne poświęcone metodom otrzymywania soli stanowią ważny element edukacji chemicznej na poziomie gimnazjalnym. Skuteczne przekazywanie wiedzy wymaga balansu między uproszczeniem a precyzją, odniesień do praktyki oraz wykorzystania odpowiednich wizualizacji i przykładów.