Cześć! Dziś zajmiemy się masą cząsteczkową kwasu siarkowego 6. Przygotuj się na wizualną podróż po świecie atomów!
Masa cząsteczkowa, co to takiego? Pomyśl o wadze jednego, malutkiego "klocka" kwasu siarkowego. To właśnie masa cząsteczkowa!
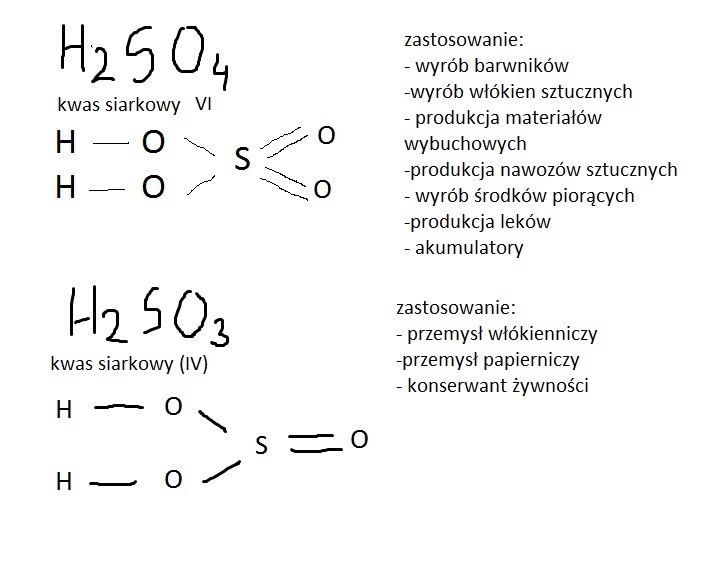
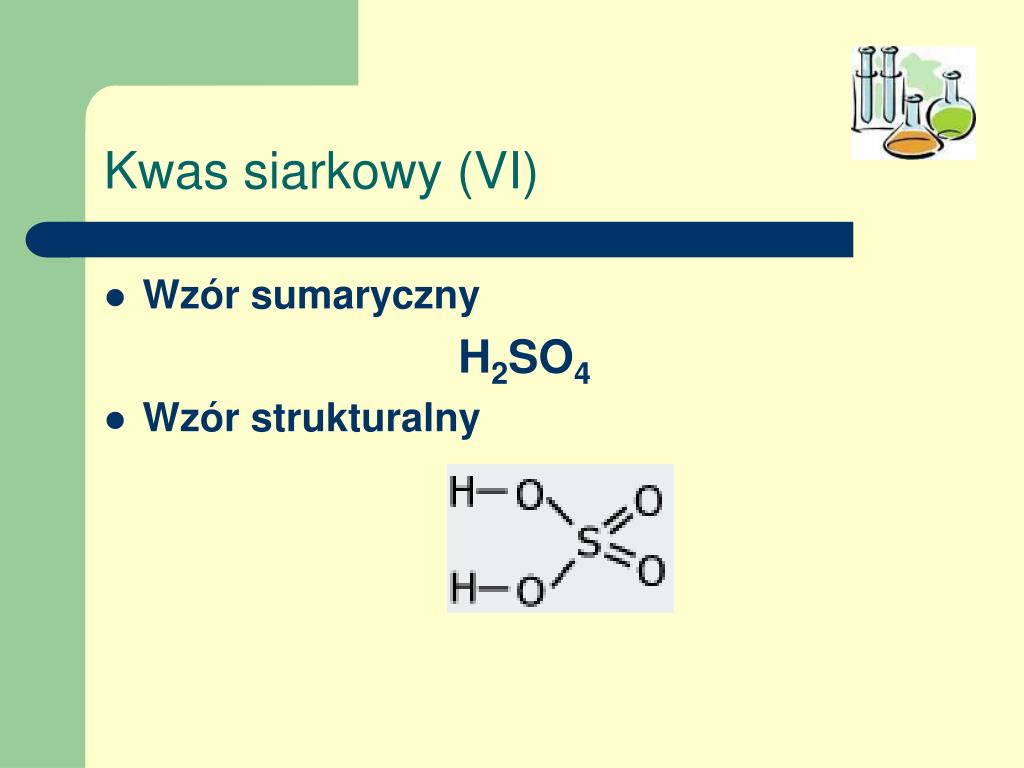
Kwas siarkowy 6 to inaczej H2SO4. Ten wzór to przepis na kwas siarkowy. Mówi nam, z jakich "klocków" się składa.
Składniki przepisu: H, S, O
Widzimy tutaj trzy rodzaje atomów: wodór (H), siarkę (S) i tlen (O). Każdy z nich ma swoją wagę, którą znajdziemy w układzie okresowym pierwiastków. Wyobraź sobie, że układ okresowy to tablica z wagami każdego rodzaju atomu!
Masa atomowa wodoru (H)
Wodór to najlżejszy z tych trzech. Jego masa atomowa to około 1 u (unit). Pomyśl o nim jak o lekkiej piórce.
Masa atomowa siarki (S)
Siarka jest cięższa od wodoru. Jej masa atomowa to około 32 u. Wyobraź sobie ją jako mały kamień.
Masa atomowa tlenu (O)
Tlen znajduje się pomiędzy wodorem a siarką pod względem masy. Jego masa atomowa to około 16 u. Możemy sobie go wyobrazić jako szklaną kulkę.
Liczymy! Krok po kroku
Teraz, kiedy znamy wagi poszczególnych atomów, możemy obliczyć masę cząsteczkową H2SO4. Traktujemy to jak obliczanie wagi całej budowli z naszych "klocków".
Krok 1: Wodór. Mamy dwa atomy wodoru (H2). Więc 2 * 1 u = 2 u. To jak waga dwóch piórek.
Krok 2: Siarka. Mamy jeden atom siarki (S). Więc 1 * 32 u = 32 u. To waga naszego jednego kamienia.
Krok 3: Tlen. Mamy cztery atomy tlenu (O4). Więc 4 * 16 u = 64 u. To waga czterech szklanych kulek.
Krok 4: Dodajemy wszystko razem. 2 u (wodór) + 32 u (siarka) + 64 u (tlen) = 98 u.
Gotowe! Masa cząsteczkowa kwasu siarkowego 6 (H2SO4) wynosi 98 u.
Przykład wizualny: Waga z klocków
Wyobraź sobie wagę szalkową. Na jednej szalce kładziemy dwa "klocki" wodoru (po 1 u każdy), jeden "klock" siarki (32 u) i cztery "klocki" tlenu (po 16 u każdy). Łączna waga na tej szalce to 98 u. Ta waga to masa cząsteczkowa kwasu siarkowego!
Dlaczego to jest ważne?
Znajomość masy cząsteczkowej jest kluczowa w chemii. Pozwala nam obliczać ilości potrzebne do reakcji chemicznych. To jak znanie proporcji składników w przepisie na ciasto! Jeśli ich nie znasz, ciasto może się nie udać.
Na przykład, wiedząc, że masa cząsteczkowa kwasu siarkowego wynosi 98 u, możemy obliczyć ile gramów kwasu siarkowego potrzebujemy do reakcji z określoną ilością innej substancji. To podstawa w laboratoriach i przemyśle!
Inne przykłady i porównania
Pomyśl o budowaniu z Lego. Każdy klocek ma określoną wagę. Masa całej konstrukcji to suma wag wszystkich klocków. Podobnie jest z cząsteczkami i atomami!
Masa cząsteczkowa jest trochę jak waga samochodu. Wiemy, że samochód waży więcej niż rower, bo składa się z większej ilości części, z cięższych materiałów. Cząsteczki są zbudowane z atomów, więc ich masa zależy od rodzaju i ilości atomów.
Kwas siarkowy to mocna substancja, używana w wielu gałęziach przemysłu. Ale pamiętaj! Zawsze pracuj z nim ostrożnie i pod nadzorem. Bezpieczeństwo przede wszystkim!
Podsumowanie
Mam nadzieję, że teraz rozumiesz, czym jest masa cząsteczkowa kwasu siarkowego 6 (H2SO4). Pamiętaj o "klockach" atomów, ich wagach w układzie okresowym i dodawaniu, jak w przepisie kulinarnym. Powodzenia w dalszej nauce chemii!